助力基因治療,賽業iPSC體外疾病模型研究平臺上線

科研人員困惑:iPSC細胞點突變無純合基因型?iPSC細胞基因編輯時總是分化?iPSC細胞基因修飾后拿不到單克隆?
iPSC體外疾病模型研究平臺來幫你!
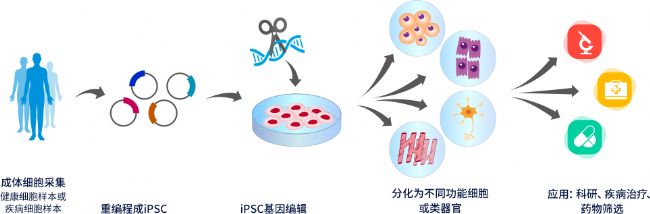
圖1 iPSC體外疾病模型研究思路
誘導多能干細胞(iPSC)能再分化成特定的細胞類型、組織和器官,聯合基因編輯技術使用,可用于探索疾病發生的機制、開發新型有效的藥物和細胞治療等。賽業生物iPSC體外疾病模型研究平臺,擁有成熟的基因編輯技術和干細胞培養體系,攻克了iPS細胞培養難、基因編輯、單克隆化難等多方面問題,同時結合一站式表型分析服務,可為客戶打造多種疾病應用場景的體外模型構建和檢測服務。

歡迎掃碼聯系我們
01 使用iPSC體外疾病模型的優勢
1、小鼠模型不能完全展現人類疾病的表型與發生機制,使用基因編輯iPSC細胞疾病模型更能模擬人類疾病的發生。
2、可創造遺傳背景單一的細胞系,減少因遺傳背景差異而導致的表型變異。
3、iPSC在體外可無限擴增和定向分化,有利于大規模的藥物篩選和替代較難獲得的原代細胞系。
02 iPSC體外疾病模型服務內容及交付標準
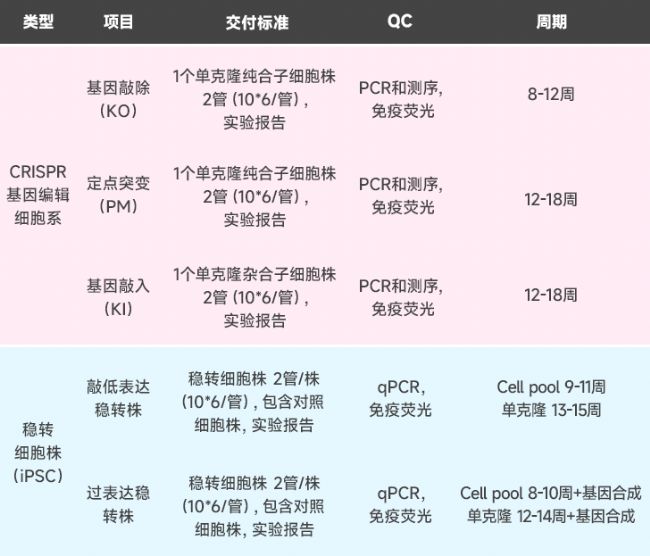
*額外檢測服務根據客戶需求:可提供核型、脫靶、流式、WB、luciferase、增殖、凋亡、周期、遷移/侵襲等。
03 構建iPSC體外疾病模型的技術難點與解決方案
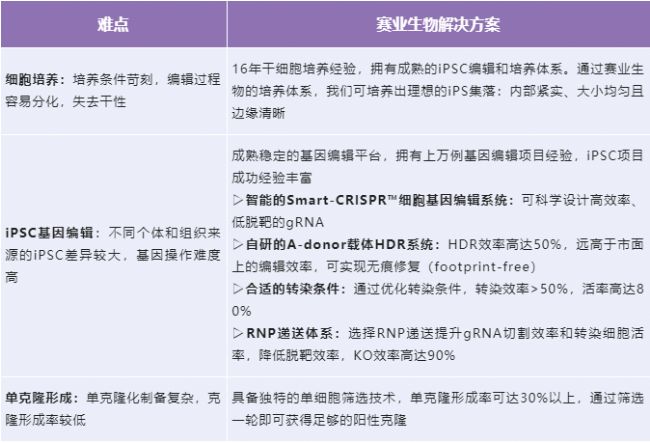
04 賽業iPSC基因修飾的技術優勢
1、成熟基因編輯技術平臺:從體內動物實驗到體外細胞實驗,上萬例成功基因編輯項目積累。
2、優化升級的iPSC基因編輯體系:新升級遞送載體HDR效率達到50%,轉染效率>50%,轉染活率>80%。
3、獨創Smart-CRISPR™技術:全新升級的細胞基因編輯系統Smart-CRISPR™,輕松實現基因敲除、基因敲入除等多種策略,編輯效率高達90%。
4、快速交付:穩轉株周期快至8周,基因敲除周期快至8周,敲入周期快至12周。
5、專業的項目管理:24h內出方案,定期反饋項目進展,博士團隊技術支持,詳盡的交付報告,并可根據要求提供不同克隆(純合子、雜合子和對照)細胞的交付。
05 iPSC體外疾病模型服務案例
iPSC-EGFP-KI細胞模型建立
通過CRISPR/Cas9基因編輯技術,在誘導性多能干細胞iPSC中的某基因中插入EGFP熒光標記(700bp)。如下圖所示,在外顯子E2的上下游設計sgRNA,并設計包含EGFP的Donor序列。通過RNP法將sgRNA和Donor轉染到iPSC中,經過HDR途徑將EGFP序列插入外顯子E2序列的后段。

圖2 EGFP敲入方案設計
經過PCR和測序鑒定,確定獲得在外顯子E2序列后插入EGFP的雜合iPSC細胞系。細胞培養后經G顯帶進行染色體核型分析,顯示染色體數為46數目正常,染色體結構無明顯異常。通過免疫熒光染色,檢測NANOG、OCT4和SOX2三個干性標記基因,均能檢測出陽性信號,表明該敲入細胞具有干性。
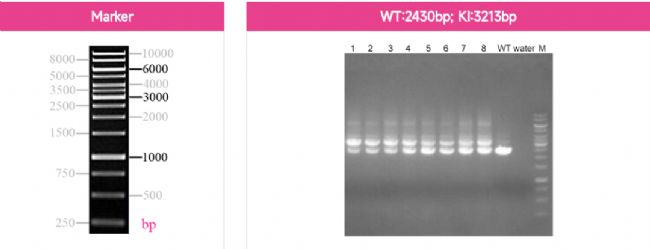
圖3 iPS-EGFP KI瓊脂糖凝膠電泳鑒定結果
(來源:賽業生物)
(來源:賽業生物)
注:引物設計策略為擴增整個EGFP及其所在基因組上下游的部分序列。無插入EGFP的帶型為2430bp,成功插入EGFP的帶型應在3213bp處出現條帶。結果顯示,編號1到8等8個單克隆在2430bp和3213bp處出現條帶,說明這些克隆已經成功插入EGFP,且為雜合克隆。
KI條帶5’sequence:
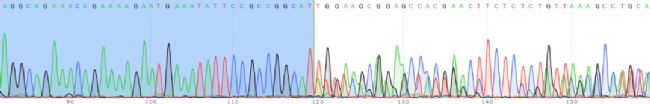
KI條帶3’sequence:

圖4 iPS-EGFP KI測序結果
注:KI條帶5’sequence展示序列為EGFP插入片段的5’端及其所在基因組的上游部分序列;KI條帶3’sequence為EGFP插入片段的3’端及其所在基因組的下游部分序列。測序分析KI條帶5’序列和3’序列均可與EGFP匹配且為套峰,證明克隆為EGFP插入片段的雜合子克隆。
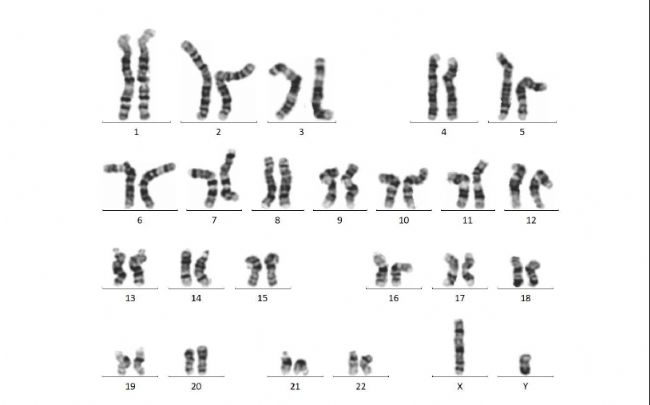
圖5 iPS-EGFP KI核型分析(細胞培養后經G顯帶進行染色體核型分析,顯示染色體數為46數目正常,染色體結構無明顯異常)
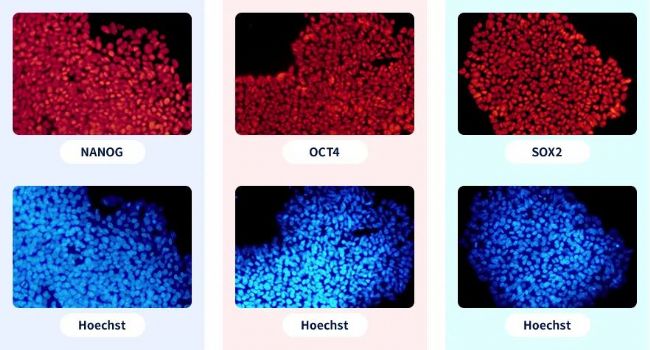
圖6 iPS-EGFP免疫熒光-干性檢測(通過免疫熒光染色,檢測NANOG、OCT4和SOX2三個干性標記基因,均能檢測出陽性信號,表明該敲入細胞具有干性)
注:通過對干細胞相關基因進行免疫熒光檢測,數據顯示IPS經過編輯后仍然具有干性
06 iPSC體外疾病模型應用場景
帕金森病機制研究——PARK2-KO-iPSC模型的構建
帕金森病(PD)是一種不可治愈的神經退行性疾病,其特征是中腦多巴胺能神經元的進行性喪失和隨后的紋狀體多巴胺耗竭。散發性和家族性PD發病機制多因為線粒體功能障礙和氧化應激。其中,PARK2基因的突變(對線粒體功能有重要影響)會導致常染色體隱性家族性帕金森病。
帕金森病發病機制中帕金森功能障礙的研究,所用到的帕金森基因敲除動物模型僅表現出輕微的疾病表型。而來自家族性PD患者的誘導多能干細胞(iPSCs)或通過基因組編輯引入的具有PARK2突變的細胞,能夠在體外研究人類多巴胺能神經元的帕金功能障礙。具有PARK2突變的PD患者iPSC衍生神經元顯示氧化應激增加、α-突觸核蛋白積累以及線粒體形態和功能紊亂。
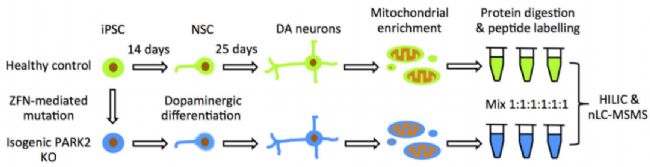
圖7 PARK2-KO-iPSC模型構建及分析[1]
作者在WT-iPSC的基礎上對PARK2進行敲除,獲得PARK2-KO-iPSC。再將WT-iPSC和PARK2-KO-iPSC分化成多巴胺能神經元。對兩種iPSC進行蛋白質組變化的通路分析,發現PARK2 KO神經元細胞周期調節、氧化應激和能量代謝的紊亂。并且通過多種實驗檢測發現PARK2-KO神經元的線粒體和形態產生異常、糖酵解和乳酸代謝不足、細胞增殖和存活率降低。
賽業生物還可提供干細胞治療心梗、過繼細胞免疫治療、阿爾茨海默病藥物篩選等更種體外模型應用場景。
賽業生物Smart-CRISPR™基因編輯系統
賽業生物扎根細胞領域十幾年,重磅開發的Smart-CRISPR™細胞基因編輯系統,通過深度的基因信息分析、優秀的gRNA設計,以及表型預測、脫靶分析等多個方面綜合考量,可提供高效率、高成功率的基因編輯方案,為您快速定制各類基因編輯單核細胞系/單克隆細胞株。
打開賽業生物Smart-CRISPR™基因編輯系統
https://www.cyagen.com/cn/zh-cn/cellbank-out/gene.html
參考文獻:
[1]Bogetofte H, Jensen P, Ryding M, et al. PARK2 Mutation Causes Metabolic Disturbances and Impaired Survival of Human iPSC-Derived Neurons. Front Cell Neurosci. 2019;13:297. Published 2019 Jul 5. doi:10.3389/fncel.2019.00297
- 博鷺騰Aniview100 Pro中標波蘭科學院采購項目
- 真邁FASTASeq 300 Dx獲批NMPA三類醫療器械注冊證
- 康寧公布2025年第一季度財務業績,強勁表現超出預期
- 慧榮和作為代表出席首屆專精特新小巨人企業生態大會
- 瑞孚迪與西湖維泰達成戰略合作共拓產前篩查新時代
- 碩果累累!谷豐光電與高校、科研機構合作成果盤點
- 復納亮相西交大分析測試論壇,深入剖析離子研磨技術
- 易科泰與法國 YellowScan 共探激光雷達市場新機遇
- 第十個中國航天日,回顧維拓啟創與中國航天的十年
- 10x Genomics技術方案更新(3月),新手冊邀您下載
- 易科泰受邀參加“十百千萬”農業新質人才培養工程
- 湘儀與重慶東暉簽約戰略合作伙伴
- Cytiva思拓凡:揚帆計劃-走入鼎康生物活動圓滿舉行
- 國儀量子EPR交流會福州大學站成功舉行
- 諾澤流體科技與德國Miccados GmbH正式達成戰略合作
- 南模生物將攜多個動物模型最新研究成果亮相AACR年會
- 南模生物邀您相約華東第17屆實驗動物科學學術交流會
- 南模生物大/小鼠實驗操作線下培訓班第二輪報名通知
- 南模生物邀您相約第二屆自免藥物及療法論壇
- 高品質實驗爪蟾上新!北京海威磐石獲準進口非洲爪蟾
- 賽業直播:從退行性疾病小鼠模型到新型AAV遞送突破
- 南模講座預告:誘導多能干細胞(iPSC)技術及應用前景
- 賽業講座:免疫重建小鼠在腫瘤免疫治療研究中的應用
- 南模直播預告:抗體藥物偶聯物(ADCs)的最新進展
- 南模直播預告:B細胞相關自免與炎癥疾病模型的構建
- 南模今晚直播:人源化自免小鼠模型構建及其應用前景
- 李勁松院士做客南模生物直播間,講述基因組標簽計劃
- 講座:人免疫系統重建小鼠在腫瘤免疫治療研究中應用
- 不同以“網”,智驅未來,賽業生物官網煥新升級
- 南模生物邀您相約第十六屆全國免疫學學術大會
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






