【小鼠大學問】轉基因小鼠的“三段進階”
小鼠轉基因的“三段進階”。
這里我們說的轉基因小鼠是指:將一段外源基因隨機插入到小鼠基因組中,獲得過量表達目的基因的小鼠模型。
轉基因1.0 顯微注射法構建完全隨機插入轉基因小鼠
用顯微注射針將線性化的外源DNA片段直接注入小鼠受精卵的原核中,使外源基因整合到小鼠基因組中,從而獲得轉基因小鼠。
優點:
- 過程較簡單
- 周期短(3個月左右獲得founder小鼠)
- 可進行大片段插入,如BAC轉基因
缺點:
- 隨機整合
- 整合位點隨機造成基因組的重排、易位缺失
- 整合位點、多拷貝串聯整合都會導致外源基因表達率低甚至不表達
- 外源基因插入可能破壞小鼠內源基因
- 獲得founder小鼠(基因型鑒定為陽性)后需要建系來篩選外源基因高表達的line,并且至少需要2個表達的line,相互印證表型才可以
也就是說:
外源DNA是怎么整合到小鼠基因組里的,你不知道。
外源DNA整合在哪里,你也不知道。
外源DNA到底有幾個拷貝整合進去了,你還是不知道。
外源DNA整合進去以后能不能被表達出來,你就更不知道了。
說白了,全靠RP。
不過有一點你可以知道,那就是獲得的founder小鼠越多,篩選到高表達line的可能性就越高。
轉基因2.0 利用DNA轉座子系統提高轉基因的表達陽性率
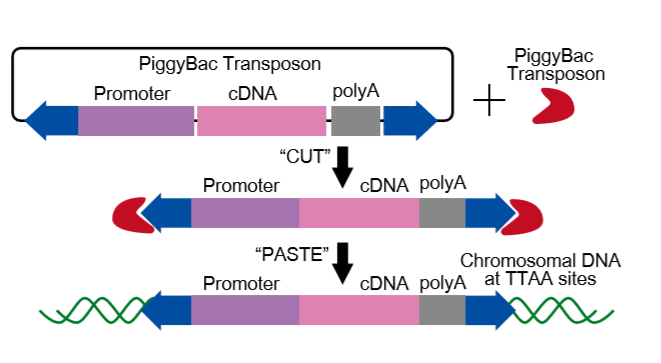
DNA轉座子的轉座遵循 “切離-粘貼 (cut and paste)”機制,在轉座酶 (transposase)的催化下 ,DNA轉座子及中間的DNA片段被從原始位置切離并插入到新的基因組位置。
用到轉基因小鼠制備的過程中,就是將外源待表達的DNA片段構建到轉座子質粒中去,并和轉座酶mRNA一起顯微注射到小鼠受精卵中,轉座酶將外源DNA片段從質粒中切離下來,插入到小鼠基因組中去。
常用于哺乳動物轉基因的轉座子有:piggyBac、SleepingBeauty (SBll) 和Tol2。其中,piggyBac轉座子在轉座酶的輔助下特異性識別基因組中5’-TTAA-3’位點,精確地剪切和插入不留下印跡;并且在隨機插入基因組的過程中,更傾向于插入有活躍轉錄的位置;而且轉座效率比其他兩個高。
轉基因1.0 vs 2.0的性能對比

從這張表格中,你不難發現 2.0進階版雖然仍舊不能確定整合位點與外源DNA的插入數量,但在相同的制備周期里, 2.0進階版提高了外源基因表達的效率,很大程度上能夠避免轉基因1.0“竹籃打水一場空”的遺憾,不失為性價比更高的一種方式。
當然,如果你和小編一樣,對不確定的事情特別沒有安全感,又對自己的RP沒什么自信的話,一定馬上就要發出這樣的怒吼了:難道就沒有一種既能明確而準確地插入外源基因又能保證表達的方法嗎?
轉基因3.0 定點轉基因 —— “一清二白”的過表達神器
一清:
整合位點清楚
二白:
1)整合拷貝數明白
2)不需要建系,后代小鼠基因型明白
更重要的是:外源基因表達有保證!
Rosa26位點是目前最為常用的定點整合位點之一。它位于小鼠6號染色體,是一個非編碼基因,已被證明在大部分組織和細胞中都有表達。表達比較活躍的基因區域因為需要轉錄因子的進入基因組結構不會被異染色質化,因此在這個區域定點插入外源基因,在各組織中表達的可能性都非常高。所以,Rosa26被廣泛用來作為外源基因表達的安全位點。當然,還有一些其它的安全位點,我們下期再詳細介紹哈~
外源DNA片段怎么整合到Rosa26位點里呢?依靠同源重組。
無論是ES細胞打靶還是CRISPR途徑,都需要構建一個同源重組載體,在Rosa26基因兩段同源臂之間放上外源基因片段。一般情況下,為了實現外源基因的高表達,可以選擇類似CAG啟動子這樣的廣泛型強啟動子。在組成型表達的基礎上,我們還可以更靈活地實現條件性——組織特異性或時間特異性——過表達,方法很簡單,就是在啟動子和外源cDNA之間加上一段兩側帶有loxP位點的multi-polyA轉錄終止(STOP)信號,像這樣:
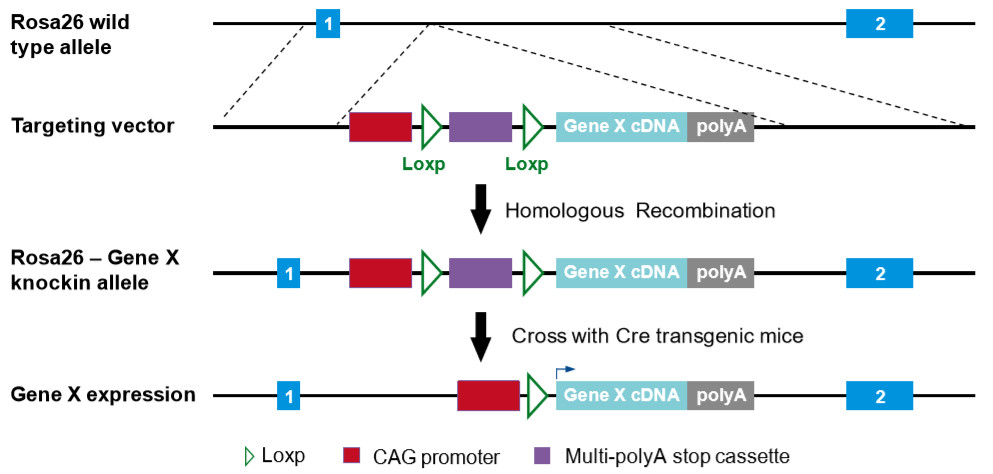
構建一個定點轉基因小鼠花費的時間會長一些,即使采用CRISPR技術也要6個月左右。不過話說回來,如果算上隨機插入轉基因小鼠的建系時間,小編覺得定點轉基因還是更有優勢噠~
你也許還會問,靠同源重組能插入幾十kb那么大的片段嗎?
不用怕,我們可以用RMCE(重組酶介導的盒式交換)來解決超大片段的定點過表達難題哦!RMCE技術基于利用Rosa26位點中帶有側翼為特定重組酶識別位點(例如:loxP、lox511位點或F3、Frt位點)的工具ES細胞系。構建帶有外源片段的第二個轉基因(側翼也帶有特異性重組酶識別位點)交換質粒,在表達重組酶(例如Cre或Flpe)的幫助下在ES細胞中催化盒式交換,從而完成超大片段(20-30kb)的定點整合。就像這樣:
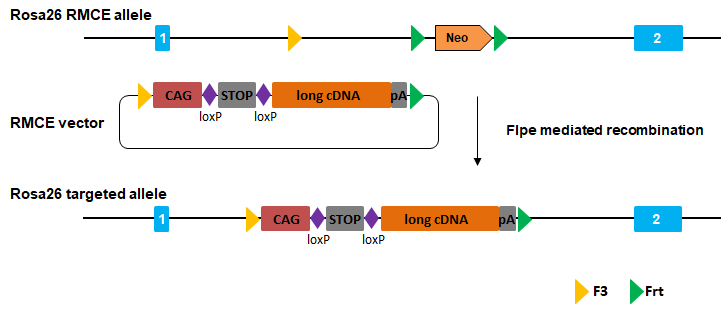
轉基因的方法很多,不同方法有它各自的優缺點,綜合考量,選擇最適合方法~





