你必須知道的肝損傷動物模型
肝臟是人體重要的器官,執行合成代謝、解毒和免疫防御等許多功能。外界環境各類因素常導致肝損傷,長期的肝損傷將誘發如肝炎、肝硬化和肝癌等疾病,最終會導致肝衰竭(如下圖)。
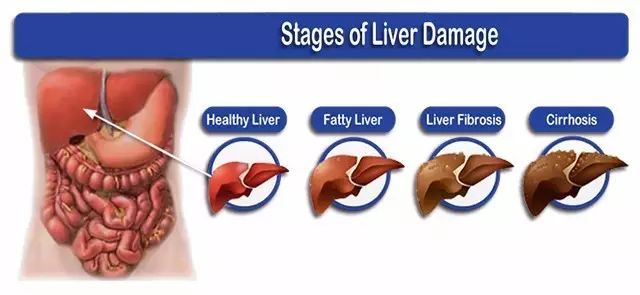 圖1. 肝損傷不同階段
圖1. 肝損傷不同階段
目前,針對各種肝損傷疾病仍然是無藥可治,肝細胞移植成為治療終末期肝損傷最有效的方法之一,然而卻面臨著供體肝細胞來源匱乏、細胞活力不足及免疫排斥等諸多挑戰。因此,科研工作者在研究肝疾病的過程中,選擇準確的肝疾病動物模型對推動肝病治療至關重要。
肝損傷相關動物模型
外源性誘導:主要是指化學性肝損傷動物模型是通過化學性肝毒物質,如四氯化碳(CCL4)、丙烯醇、D一氨基半乳糖、呋喃等化學物質致肝損傷。
舉例:CCL4可以誘發急性和慢性肝損傷,CCL4在肝臟細胞微粒體內的細胞色素P450的作用下,產生自由基及一系列氧活性物,使細胞膜、內質網膜等發生氯烷基化和脂質過氧化,損傷膜的結構和功能,最終導致肝細胞死亡。但是損傷程度無法達到肝臟再殖程度,很難模擬外界細胞植入過程。
缺陷:外源性的再生刺激對宿主細胞同樣有增殖作用,不能產生持續的肝損傷。
內源性肝損傷模型:主要是指基因突變的肝損傷模型,即動物體內可以持續發生肝損傷過程。這里應用的最廣泛的主要是指:Fah-/-基因敲除動物模型。
Fah-/-基因敲除動物模型
Fah基因編碼延胡索酰乙酰乙酸水解酶 (Fumarylacetoacetatehydrolase,Fah),正常情況下,酪氨酸最終代謝為延胡索酰和乙酰乙酸。酪氨酸代謝機制(下圖 2)
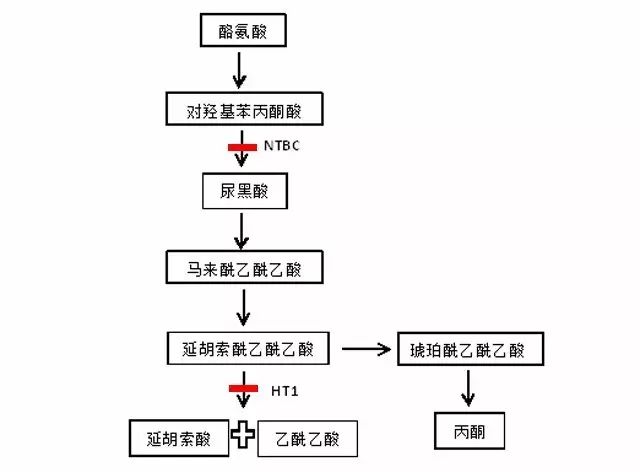 圖2.酪氨酸代謝途徑及致病機制
圖2.酪氨酸代謝途徑及致病機制
模型特征:Fah-/-基因敲除后,具備I型酪氨酸血癥(Hereditary tyrosinemia type1,HT1)典型特征。Ⅰ型酪氨酸血癥是一種因代謝酪氨酸最后一步反應所需的延胡索酰乙酰乙酸水解酶的缺失或功能缺乏而導致的常染色體隱性遺傳疾病。該酶是由Fah基因編碼,正常情況下,酪氨酸最終代謝為延胡索酰和乙酰乙酸;
當Fah基因發生缺失或突變,產生有毒的延胡索酰乙酰乙酸鹽和馬來酰乙酰乙酸,并產生其次級代謝產物丙酮,對肝、腎造成損傷。在早期階段,肝臟損傷可造成肝死亡及肝硬化,腎臟損傷會引起佝僂病及發育障礙[1]。
應用范圍:
1. Ⅰ型酪氨酸血癥HT1的研究
該模型很好模擬了HT1產生的各種癥狀,是研究該病的理想模型。臨床上NTBC雖可替代傳統的肝移植治療高酪氨酸血癥,但是仍存在副作用,而且需要持續注射來維持療效。到目前為止,還沒有一種治療方案能夠根治HT1。因此,該模型對HT1致病機理和新型替代治療方案的研究具有很高的臨床價值[2]。
2. 肝相關疾病藥物研發
由于Fah基因敲除在早期階段,肝臟損傷可造成肝死亡及肝硬化,腎臟損傷會引起佝僂病及發育障礙,因此可為此類相關疾病提供藥物篩選平臺。
3. 肝細胞移植和再殖肝臟研究
Fah基因敲除可以產生持續不可逆的肝損傷,抑制肝細胞增殖,誘發自身肝細胞死亡,具有適合移植肝細胞的生活微環境,因此被認為是評價外源性肝細胞再殖損傷的理想動物模型。如Fah-/-IL2rg-/-缺陷小鼠,存在免疫缺陷(T細胞和NK細胞缺失),同樣可進行外源干細胞移植,這為人胎來源的肝原始細胞的基礎研究及臨床應用奠定基礎[3]。
但是,Fah基因敲除小鼠和豬雖然表型類似于人類的HT1,但是不能準確模擬人類肝損傷過程,特別是肝纖維化和肝硬化過程。大鼠在體積、親緣性、遺傳特性和疾病發展機理方面與人類更加接近,因此建立該大鼠模型具有重大臨床價值[4]。
因為邦耀實驗室本身在肝疾病動物模型方面也有所研究,所以下面分享一些相關模型。目前我們通過CRISPR-Cas9技術,獲得了Fah基因缺失小鼠,構建Fah大鼠。該大鼠模型Fah基因缺失后,酪氨酸代謝受阻,毒性代謝產物蓄積,引起肝、腎的嚴重損傷。并且觀察到小鼠和豬身上沒有的肝纖維化和肝硬化。該模型的最新研究已發表在《Scientific Reports》上[5],感興趣的童鞋可以了解一下。
目前邦耀實驗室通過CRISPR-Cas9技術已成功構建Fah基因缺陷的大小鼠,如果您在實驗中有相關問題和需要,可以隨時與我們溝通聯系!
Fah-/-基因敲除大鼠
簡稱:SD –Fah-/-
基因型:純合子
模型構建:在Fah基因的第2號外顯子上敲除10個堿基
模型特點:
-
具備I型酪氨酸血癥(HT1)典型特征;
-
不僅觀察到肝功能衰竭,還具有在敲除小鼠和豬模型中看不到的肝纖維化和肝硬化特征;
-
可以成功移植外源肝細胞,使大鼠重獲肝臟正常功能。
研究應用:
Fah-/-大鼠存在廣泛而持續的肝損傷,除了應用于Ⅰ型酪氨酸血癥,還可以可用于細胞移植、肝臟持續損傷、肝再生、肝癌及肝臟疾病修復治療的研究中。
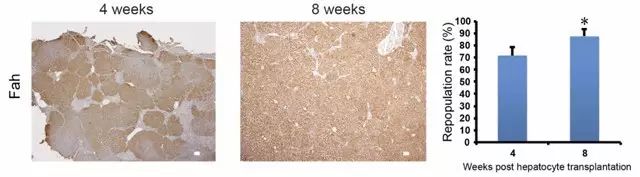
1. 大鼠肝臟組織進行Anti-Fah免疫組化染色(Fah基因缺失的小鼠無Fah抗體的表達),表明模型構建成功。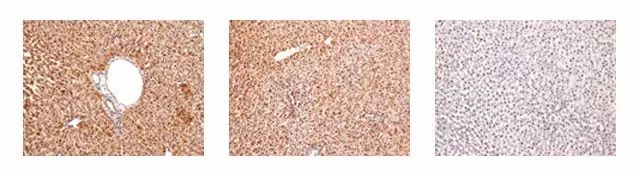
Rat liver(20×,WT),Rat liver(20×,HZ),Rat liver(20×,KO)
2. 不給予NTBC治療后Fah-/-大鼠發生肝壞死和肝硬化[5]
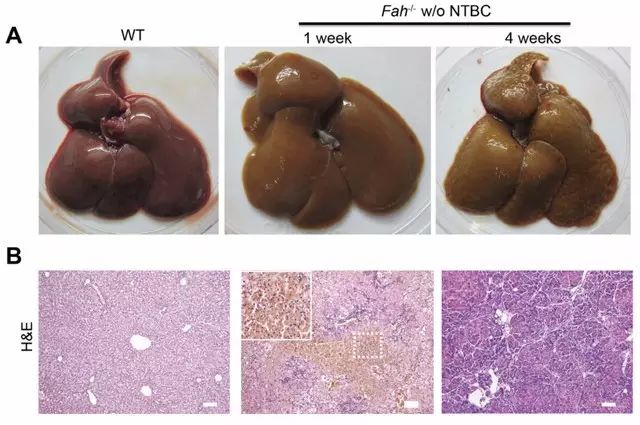
3. Fah-/-大鼠在肝細胞移植后提高肝功能和生存期[5]

參考文獻:
[1] R. Berger, G. P. Smit, S. A. Stoker-de Vries, M. Duran, D. Ketting, and S. K. Wadman, 'Deficiency of Fumarylacetoacetase in a Patient with Hereditary Tyrosinemia', Clin Chim Acta, 114 (1981), 37-44.
[2] Mohan, N. et al. Indications and outcome of liver transplantation in tyrosinaemia type 1. European journal of pediatrics 158 Suppl 2,
S49–S54 (1999).
[3] Kuijk, E. W. et al. Generation and characterization of rat liver stem cell lines and their engraftment in a rat model of liver failure. Scientific reports 6, 22154, doi: 10.1038/srep22154 (2016).
[4] Hickey, R. D. et al. Efficient Production of Fah-Null Heterozygote Pigs by Chimeric Adeno-Associated Virus-Mediated Gene Knockout and Somatic Cell Nuclear Transfer. Hepatology 54, 1351–1359, doi: 10.1002/hep.24490 (2011).
[5] Zhang L, Shao Y, Li L, et al. Efficient liver repopulation of transplanted hepatocyte prevents cirrhosis in a rat model of hereditary tyrosinemia type I.[J]. Scientific Reports, 2016.





