肺癌模型構建大全(內附獨家視頻)
肺癌發病率和死亡率
2017年2月4日,國家癌癥中心公布的最新數字顯示,在中國惡性腫瘤發病率為270.59/10萬,死亡率為163.83/10萬,其中肺癌為發病率、死亡率雙率第一,每年約59.1萬人死于肺癌,其中男性居多,約40.2萬。
同樣在美國,2017年1月5日,美國癌癥協會的統計表明,如下表所示,在美國男性和女性中肺癌的致死率依然是位居第一[1]。
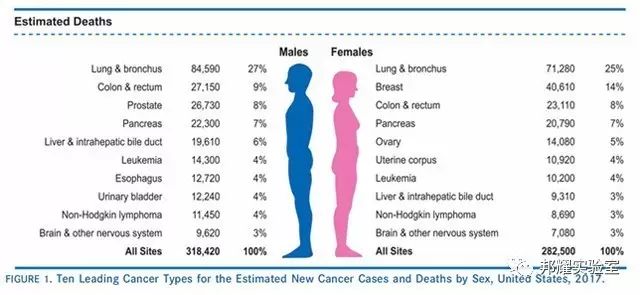 圖1. 美國癌癥發病率和死亡率
圖1. 美國癌癥發病率和死亡率
肺癌細胞的分類
根據肺癌的分化程度和形態特征,目前肺癌主要分為兩大類,即非小細胞肺癌和小細胞肺癌,前者主要包括腺癌、鱗狀細胞癌、大細胞癌[2]。

常見的肺癌模型
肺癌模型主要分為CDTX肺癌細胞移植模型(皮下移植模型和原位移植模型),PDTX(人源腫瘤組織異種移植模型)和基因修飾的肺癌模型,下面依次介紹。
一、CDTX肺癌細胞移植模型肺癌模型中,根據接種部位主要分為皮下和原位移植模型,在這類模型中需要選擇正確的肺癌細胞株,可以參考上表中肺癌細胞分類,并根據實驗目的選擇正確的荷瘤模型,如皮下荷瘤主要用于單獨研究腫瘤生長情況。
1. 皮下荷瘤
定義:根據研究的肺癌類型及基因突變情況,選取狀態好的腫瘤細胞移植于小鼠皮下。例如,我們研究KRAS突變的肺癌,通常選取KRAS突變的A549細胞,細胞量為1x106-3x106/只。具體的操作視頻和分組請參考往期內容(3.8 移植性腫瘤模型的建立之皮下荷瘤),此處不再贅述。
2. 原位荷瘤
定義:將腫瘤細胞通過注射等方式移植到模式動物肺部構建的動物模型。
模型優點:與皮下荷瘤模型相比,能更好反映腫瘤在人體內的一個發生發展及轉移過程。
實驗操作方法:
-
細胞系選擇及準備工作
為了便于觀察肺癌細胞在體內生長情況,選用帶熒光素酶(Luciferase)標簽的A549細胞,取對數生長期的A549-Luc(106/只)用胰酶消化收集,1×PBS洗兩次,用PBS重懸后與生長因子減少的Matrigel基質膠按1:1的比例混合,每只老鼠注射100µl含1×106個細胞的混合懸液;
-
小鼠的準備工作
選取6-8周齡的Balb/c無胸腺裸鼠,置于超凈工作臺中麻醉,裸鼠由興奮狀態轉為麻醉狀態后將其以右側臥位固定,胸腔表面用酒精消毒。
-
切口位置的選取,確定肺部位置
確定位置:位于小鼠左側肋弓下緣以上約1cm處(第四、五肋弓之間),這一部位有兩條縱向較粗的血管,肺部位于這兩條血管之間(視頻中用黑色marker筆標注位置);
露出肺部:先將表皮剪一約5mm的小口,沿此小口逐步剪開下層皮下及肌肉組織,隔著胸膜可以看到粉色的肺部,肺部會隨著小鼠的呼吸收縮和擴張。
-
腫瘤細胞注射
取混勻的100µl的細胞懸液,沿著切口對準小鼠的左肺緩慢注射,進針深度約為3mm,注射結束后停針5s,左右旋轉慢速出針。
-
小鼠傷口縫合
將剪開的小鼠表皮進行縫合,將小鼠以右側臥位(使傷口朝上)置于37℃恒溫加熱板上直至小鼠蘇醒,放回原籠中繼續飼養,4-6天傷口即可愈合。
視頻:
https://v.qq.com/x/page/y0519t9zogt.html
注意事項:
1. 為什么使用Matrigel?
如果腫瘤細胞僅用PBS重懸便注射到小鼠肺部,細胞可能隨肺部氣管快速擴散,造成氣管堵塞導致小鼠死亡,使用Matrigel與細胞混合后進行實驗便可降低小鼠死亡風險。
2. 如何避免出血?
操作過程中要避開較粗的血管,以免流血影響后續實驗操作以及肺部的觀察;并且最好選用胰島素注射器,由于注射器針頭扎入肺部有可能損傷肺部大血管,很容易造成小鼠的死亡,因此注射器最好選用針頭較細的胰島素注射器。
3. 注意整個操作過程及手術器械要保持無菌,以免小鼠感染[3]。
后續分組和試驗分析
分組時間:一般原位注射一周后,裸鼠肺癌原位模型建成,進行分組(n=10);
如何分組:依據裸鼠體重腹腔注射相應劑量的D-luciferin (Xenogen) 熒光底物(150 mg/kg),將裸鼠放置于麻醉箱中通以2.5%異氟烷/氧,待裸鼠麻醉后轉入IVIS廂室中,使其腹面朝下并持續通以麻醉氣體,注射底物10min后,進行熒光成像,測量各裸鼠肺部初始熒光值,依據熒光值的大小平均分組。隨后可進行給藥等實驗,定期進行熒光檢測。
人道終點:動物倫理學規定,小鼠腫瘤重量不可超過小鼠體重10%,平均腫瘤直徑不超過20mm,并且如果出現潰爛,并且嚴重轉移,造成感染或壞死時,應該中止實驗且對動物施行安樂死。
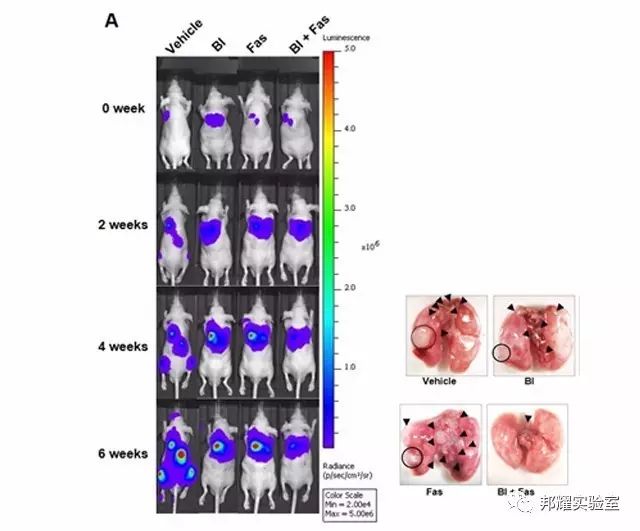 圖2. 肺部原位注射的熒光圖和肺部白光圖[4]
圖2. 肺部原位注射的熒光圖和肺部白光圖[4]
定義:將病人肺癌組織移植到小鼠皮下等部位,主要用于抑制腫瘤生長(細胞增殖)的藥物的篩選檢測,在近年該模型越來越受重視。
模型優點:因為取自病人的腫瘤組織,在組織形態和遺傳特征等方面均與人類腫瘤相同,故這種模型可以更貼近人類腫瘤的生物學特性。
實驗操作方法:
1)處理新鮮肺癌組織:在無菌條件下的冰上對新鮮離體的肺癌腫瘤組織,剔除包膜及壞死組織,切成約15mm3(2mm×2mm×3mm)的小塊;
2)首次接種小鼠:將切好的組織碎片用鑷子填入定制的套管針尖端內,注射到5-6周NOD/SCID重癥聯合免疫缺陷小鼠背部皮下,每只老鼠背部可以接種1-2個位點,每例腫瘤接種2-3只小鼠,此接種過程須在腫瘤標本離體后2h之內完成,為提高成瘤率腫瘤塊也可混合10% Matrigel進行荷瘤;
3)再次傳代:當裸鼠皮下腫瘤生長至1000 mm3左右,表示移植成功,對其處于對數增長期的原代(F1代)皮下移植小鼠模型進行傳代。
-
剝離皮下腫瘤,部分組織速凍至液氮備用或經4%多聚甲醛固定后石蠟包埋;
-
另一部分組織按照上述接種步驟,移植到4-5只裸鼠皮下,建立第二代移植小鼠模型(F2代);
-
按照此流程,在裸鼠體內連續傳代3代后,移植瘤的生長速度開始穩定,可進行體內動物模型實驗。
后續試驗分析:
待皮下腫瘤組織長到一定體積,進行分組(n=10),保證最終可獲得6個以上有效數據。
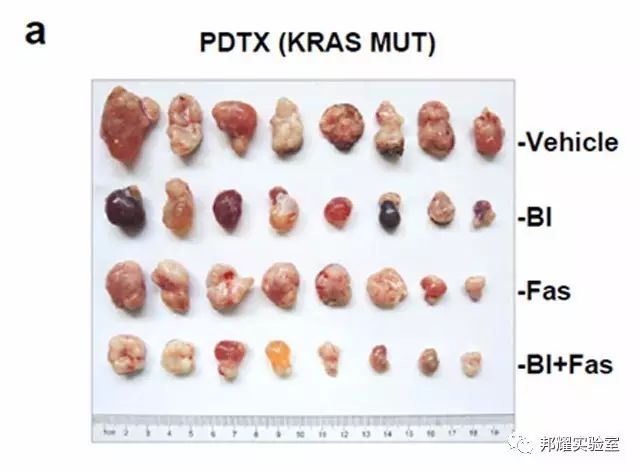 不同處理組的肺癌的PDTX模型[4]
不同處理組的肺癌的PDTX模型[4]
定義:主要是利用基因編輯技術如CRISPR/Cas9進行敲除或插入特定基因,從而誘發動物產生腫瘤的模型。肺癌基因修飾模型主要是KRAS突變誘導肺癌等產生,KRAS突變同時P53缺失會加速腫瘤的發生發展。
模型優點:主要用于腫瘤發生發展過程及作用機制的研究;同時原癌基因的頻發突變是腫瘤產生的重要原因之一,因此靶向這部分原癌基因的抗腫瘤藥物篩選是一個重要方向。
構建方法:可以參考我們往期基因編輯小鼠構建過程(包括KO,KI,CKO小鼠的構建等)
舉例:Lox-STOP-Lox-KrasG12D Conditional Mouse Model
Ras在人類腫瘤頻發突變,K-ras的激活突變是肺部腫瘤產生的原因之一。在k-ras locus上敲入了Lox-Stop-Lox-KrasG12D,通過小鼠鼻腔注入Ad-Cre重組腺病毒,誘導肺中的K-rasG12D表達,從而誘發肺癌[5]。
應用:由于其產生的機制及組織形態和遺傳特征等方面均與人類K-ras突變腫瘤相似,因此該模型能夠很好的評價針對K-ras突變的抗腫瘤藥物活性[4]。
準確的肺癌動物模型至關重要,它是獲得正確實驗數據和發表文章的重要前提,本期我們根據多年的經驗,為大家總結了3種常見的肺癌模型。隨后,我們會繼續介紹其他腫瘤模型的構建,所以做其他腫瘤方向的童鞋不要著急,后期內容會越來越精彩。如果您覺得我們的內容還不錯,快快點擊上方藍字關注吧!
參考文獻
[1]Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017. CA Cancer J Clin. 2017 Jan;67(1):7-30.
[2]Lung Carcinoma: Tumors of the Lungs. Merck Manual Professional Edition, Online edition. [2007-08-15].
[3]Wang YW, Wang XW, Wei JM, et al. Establishment of NSCLC in situ metas- tasis model using GFP/A549 cells. J Shandong Univer (Health Sciences), 2006, 44(7): 698-702.
[4]Wang J, Hu K, Guo J, et al. Suppression of KRas-mutant cancer through the combined inhibition of KRAS with PLK1 and ROCK[J]. Nature Communications,2016: 11363-11363.
[5]Michel DuPage, Alison L Dooley & Tyler Jack. Conditional mouse lung cancer models using adenoviral or lentiviral delivery of Cre recombinase .Nat Protoc. 2009;4(7):1064-72.





