腫瘤動物模型的構建——乳腺癌篇
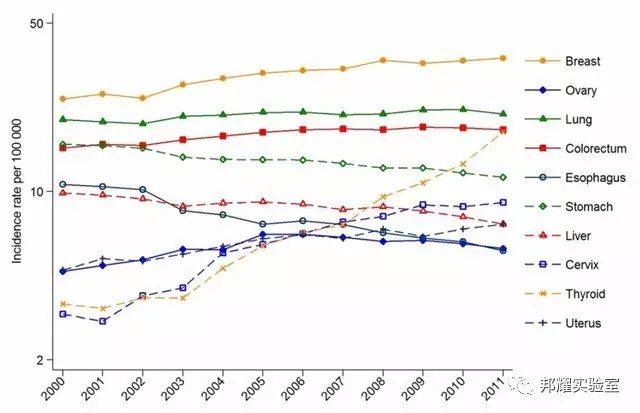 在中國近10年乳腺癌在女性中的發病率[1]
在中國近10年乳腺癌在女性中的發病率[1]
首先,讓我們先了解一下乳腺癌分型和乳腺癌細胞的分類
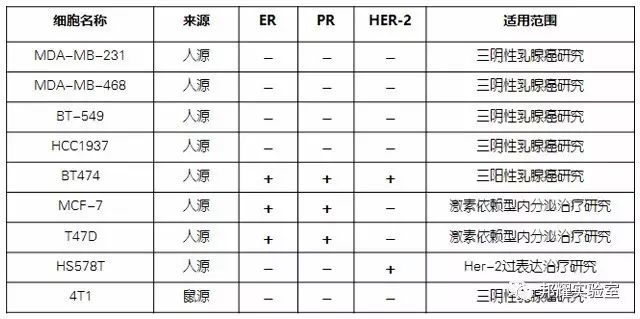
不同分子分型的乳腺癌細胞根據其靶點的表達量對應不同類型的乳腺癌研究,我們需要根據實驗研究目的選擇正確的細胞株進行動物實驗。如需研究三陰性乳腺癌的生長和轉移,常選擇基底樣的人源細胞株MDA-MB-231或者鼠源細胞株4T1。
乳腺癌分型:
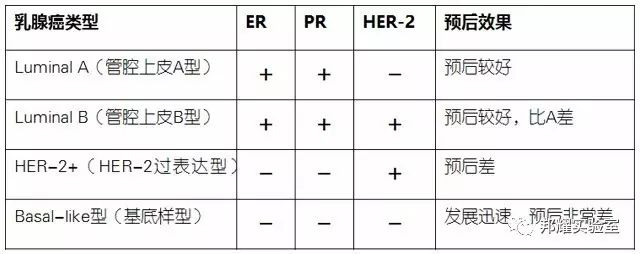
臨床上,乳腺癌根據分子分型:ER(雌激素受體)、PR(孕激素受體)和HER-2(人類表皮生長因子受體2),可將乳腺癌劃分為以下四大類:
進一步,根據這些靶點又分了多種細胞株,如下表我們列舉了研究中常用到的細胞株:
 了解到上述乳腺癌分型,那研究中的乳腺癌動物模型有哪些呢?
了解到上述乳腺癌分型,那研究中的乳腺癌動物模型有哪些呢?
乳腺癌動物模型根據腫瘤發生原理,主要分為四種:
1. 自發型乳腺癌動物模型(很少使用)
實驗動物未經任何有意識的人工處理,自然發生乳腺癌。多采用近交系小鼠,如C3H、SHN小鼠,生長到一定年齡便自然發生乳腺癌腫瘤。此動物模型更貼近人類腫瘤的發展,但構建時間長,誤差大,一般不建議使用等。
2. 誘發型乳腺癌動物模型(較少使用)
使用化學物質、物理、生物因素通過經口、涂抹、注射等方法應用實驗動物,使之發生乳腺癌。常見化學誘導方式是以二甲基苯蒽(DMBA)和甲基亞硝酸基脲(MNU)為誘導劑誘發乳腺癌。
這種方法誘發成瘤率較高,但誘癌過程較長,個體差異較大,不易同時獲得病程或者腫瘤大小均一的動物模型,不利于應用于抗腫瘤藥物的篩選研究。
以DMBA誘導大鼠乳腺癌模型為例:
取7周齡的健康雌性SD,根據體重將80mg/kg DMBA稀釋在0.5ml玉米油中,灌胃一次,12周后,可建立乳腺癌病變動物模型[2]。
3. 移植型乳腺癌動物模型(最常用,易構建)
定義:將人體或者其它種屬的動物腫瘤組織或者細胞移植到免疫缺陷動物身上使其生長成腫瘤的動物模型。
優點:周期短,成本低,個體差異小,無自發緩解,成瘤率高等,目前實驗室應用最多。
分類:
-
根據移植對象可分為腫瘤組織接種、組織塊懸液注射、細胞懸液注射;
-
根據移植物來源可分為同種移植和異種移植,其中異種移植需移植于免疫缺陷小鼠中,常用的是T細胞免疫功能缺陷的裸鼠或者T、B細胞免疫功能嚴重缺陷的嚴重聯合免疫缺陷(SCID)小鼠;
-
根據移植部位可分為原位移植和異位移植,其中異位移植按照實驗目的不同,可分為皮下移植、檢測肺轉移的尾靜脈注射、檢測骨和腦轉移的左心室注射等,具體細節參照前文。
詳細移植步驟可以參考下面高清視頻,配套詳細字幕注解:(包括皮下注射、原位注射、尾靜脈和左心室注射四種實驗技巧)
https://v.qq.com/x/page/i0522vo8wbi.html
溫馨提示:請在Wi-Fi下觀看,土豪隨意
4. 轉基因型乳腺癌動物模型(根據研究需要選擇)
定義:主要是利用基因編輯技術如CRISPR/Cas9進行敲除或插入特定基因,從而誘發動物產生腫瘤的模型。此模型具有穩定的高發病率,便于觀察,已成為研究乳腺癌發病機理的良好的動物模型。
目前研究較多的是乳腺特異的啟動子,如在鼠乳腺腫瘤病毒長末端重復啟動子(MMTV-LTR)的作用下表達癌基因。
MMTV是導致小鼠乳腺腫瘤的重要病毒,而是利用其病毒組織特異啟動子及增強子功能非(致癌特性),介導癌基因ERBB2、PyMT、Wnt-1在小鼠乳腺高表達而發生乳腺癌。除外常用的有:抑癌基因Tp53敲除小鼠、乳腺癌抑制基因(BRCA)敲除小鼠等。
以MMTV-PyMT轉基因乳腺癌模型為例,乳腺癌相關轉錄因子Runx1隨著病程發展而表達上升[3]。
腫瘤動物模型是我們機制研究和新藥研發中必不可少的工具,本文結合我們的實戰經驗,為大家綜述了在乳腺癌研究中最常用的動物模型。相信對于腫瘤研究的你應該是非常受用吧,邦耀實驗室助力解決你的各種實驗難題,希望做科研的你能學以致用,早日發表高分文章!
參考文獻:
[1] Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015.[J]. CA: A Cancer Journal for Clinicians, 2016, 66(2): 115-132.
[2] Kalyani Chowdary Karnama, Maheswara Ellutlaa, et al. Preventive effect of berberine against DMBA-induced breast cancer in female Sprague Dawley rats. [J]. Biomedicine & Pharmacotherapy 92 (2017) 207–214.
[3] Browne G, Taipaleenmaki H, Bishop N, et al. Runx1 is associated with breast cancer progression in MMTV‐PyMT transgenic mice and its depletion in vitro inhibits migration and invasion[J]. Journal of Cellular Physiology, 2015, 230(10): 2522-2532.





