PeproTech 為您總結小鼠小腸類器官培養方法與技術要點
 |
|
小鼠小腸類器官的培養說起來容易,操作起來好像也并不是那么簡單的,小腸類器官的培養較為繁瑣,尤其是獲取原始干細胞操作步驟多、操作時間長,而且培養過程中也有頗多注意事項。對于初學者來說,此實驗并不是那么友好,稍不注意一些操作細節,很可能導致培養失敗。 |
| 但是!別怕。 |
| PeproTech技術員已經親自實踐操作,趟過一遍泥濘的路~嘔心瀝血總結了非常全面的小鼠小腸類器官的培養方法和注意事項, 快點讀起來吧! |
|
♦ 前言 ♦ 2009年,荷蘭科學家Hans Clevers的團隊成功地在體外將Lgr5+腸道干細胞培養成包括隱窩樣區域和絨毛樣上皮區域的三維結構,即小腸類器官。這一結構包含所有終末分化細胞類型,能準確模擬腸道上皮生理情況,這一方法的建立既實現了腸上皮長期體外培養又可以維持腸上皮細胞原始分化能力,該技術已經逐漸被應用于干細胞、疾病模型以及再生藥物等相關研究。
小腸類器官的培養可以通過多能誘導干細胞或胚胎干細胞來誘導分化,也可以取小腸的隱窩干細胞來誘導分化。目前大多數研究都是采用小腸隱窩干細胞來培養,因為該方法不僅獲取干細胞方便,對技術的要求不高,而且培養的類器官傳代次數更多,可以在體外長期培養長達2個月之久。 |
| ♦ 小腸類器官的制備方法 ♦ |
|
1)將小鼠斷頸處死后,收集自末端回腸起約15cm腸斷,置于冰的PBS 洗滌液液中,使用尖頭鑷子去除腸道外部的膜、血管和脂肪,用注射器從小腸一端注入PBS進行沖洗;
2)使用小剪刀,將腸段縱向切開,腸腔朝上打開。用冰冷的PBS(2-8°C)輕輕洗滌切開的腸道片段,用玻片刮出腸管內容物和絨毛結構,再次用冰冷的PBS沖洗; 3)向50 mL離心管加入15 mL冰冷的PBS。用鑷子夾住腸道一端,并懸在管口上。從腸道底部開始,用剪刀將腸切成1~2毫米的小片,讓這些碎片落入管內的緩沖液中; 4)用PBS預先潤濕10 mL移液管,加入15 mL冰冷的PBS清洗腸道碎片5~10次,直至上清液變澄清; |
 |
| 圖一:小腸組織清洗澄清后的上清液 |
|
5)除去上清液,將組織碎片重懸于25 mL小腸隱窩消化液中,在冰上孵育20 min,冰盒置于20 rpm轉速搖床上旋轉30 min; 小腸隱窩消化液:2-5 mM的EDTA, 此步驟后可以讓組織碎片自然沉降后去除上清,繼續消化一次。 6)讓組織碎片通過重力沉降約1 min。小心吸出并丟棄消化液,留下足夠的液體以沒過組織碎片; 7)將組織碎片重懸于10 mL10%FBS冷的(2-8℃)PBS緩沖液,并用移液管上下吹打三次。靜置直到大部分腸組織碎片沉降到底部; |
 |
| 圖二:吹打后的小腸上清液,含有小腸隱窩 |
8)小心吸取上清液并使用70 μm濾網過濾,將濾液收集于干凈的50 mL管中; 9)重復上述7-8二次,將獲得的三份過濾液混合; 10)在2-8 ℃下將上述混合液以290×g離心5分鐘。小心地倒出并丟棄上清液; 11)將沉淀重懸于含有10 mLPBS緩沖液中。200×g離心3分鐘。輕輕倒出上清液。將腸隱窩沉淀留在管中。根據沉淀量加入適當體積的基礎培養基重懸沉淀,如果單細胞過多,可200 r /min 離心2 min 收集上清以去除單細胞; 12)計數,吸取10 μL置于玻璃載玻片或血細胞計數器上。使用倒置顯微鏡,計數10 μL樣本中的隱窩數量,200 g離心5 min,小心吸出并棄去上清; |
| 配制類器官培養基 |
| 在基礎培養基中加入: |
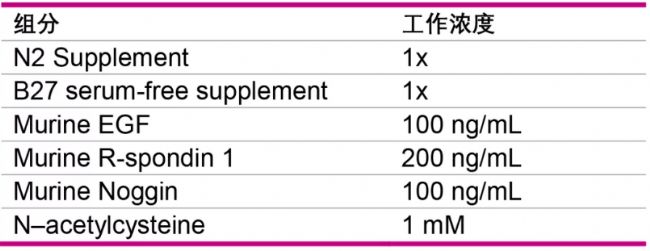 |
| 注:基礎培養基應當含有10mM HEPES、L-谷氨酰胺 13)用類器官培養基將隱窩的密度重懸至8-20個/μL,取出150 μL隱窩懸液,加入等體積的未稀釋的基質膠混合隱窩,小心地上下吹打十次以充分混勻,注意避免產生氣泡; 14)吸取50 μL懸液,加入到提前預熱的24孔板每個孔中的中心部位,樣品應在每個孔的中心形成圓頂結構。為了防止接種時出現氣泡,槍頭內液體不要全部打出; 15)將培養板在37 °C下靜置10分鐘以待基質膠完全凝固。將平板轉放入培養箱時,應注意不要破壞凝固后的液滴; |
 |
| 圖三:基質膠種板后的形成的液體 |
| 16)使用移液槍沿著孔側壁向每個孔中輕輕地加入500 μL室溫(15-25℃)的配置的類器官培養基。不要將培養基從圓頂結構上直接加入; 17)向其它未接種的孔中加入無菌PBS以保證培養時的濕度。 將培養板的蓋子蓋好,并在37 ℃和5%CO2下進行培養; 18)觀測類器官生長情況。通常,隱窩開始培養約3小時后形成球狀結構,通常在培養2至4天后,小腸類器官開始出芽,并且在第5至7天形成復雜的出芽狀結構; 19)隔天進行完全換液。換液時將移液槍頭放在孔底邊緣小心地將原有液體培養基吸出,并加入為500 μL新鮮的室溫類器官培養基。 |
 |
| 圖四、培養10天后的小腸類器官 |
| ♦ 小腸類器官培養注意事項 ♦ |
|
1)腸道外部的膜、血管和脂肪,盡量去除干凈,否則后續得到的分餾會有很多雜細胞污染; |
| ♦ 小腸類器官的傳代培養 ♦ |
|
1)在成熟類器官的24孔板中,每孔加入約1000基礎培養基,用1 mL槍頭吹打板底的基質膠,直到基質膠全部打碎,收集每個孔中的懸液置于15 mL離心管中; |
 |
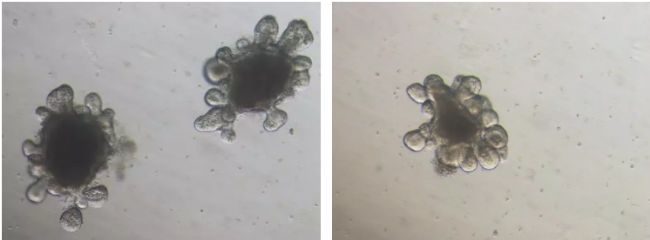
| 左圖為小腸隱窩干細胞在基質膠中培養7天結果,右圖為小腸類器官傳代在基質膠中培養3天結果 |
♦ 小腸類器官的凍存與復蘇 ♦ |
|
準備凍存液:10%二甲基亞砜(DMSO)+20%胎牛血清(FBS)+70%DMEM/F12
1)將需要凍存的類器官冰上放置5~10 min; 復蘇準備:37 ℃水浴箱 |
| ♦ 培養用相關試劑 ♦ |
 |
| 注:基礎培養基內含有10 mM HEPES、L-谷氨酰胺,因此無需額外添加。 |
|
|