從法規監管視角看制藥工藝中取樣的風險緩解
制藥工藝精選 | 從法規監管視角看制藥工藝中取樣的風險緩解
制藥生產過程微生物污染往往引發嚴重后果, 污染增加了操作員,公司和患者的風險,所有這些都可能導致嚴重的負面影響。 生物的污染會導致生產設施長時間關閉,以進行必要的調查,查明根本原因并防止再次發生,這將延緩關鍵性救生藥物的生產和交付。
生物制藥生產過程中,不論是中間體還是最終產品的取樣對于生產至關重要。 除了通過生物負荷監測確保患者安全外,還需要進行取樣以支持由全球監管趨勢驅動的幾個關鍵必要事項,包括過程分析技術(PAT)和設計源于質量(QbD)(圖1)。
制藥生產過程微生物污染往往引發嚴重后果, 污染增加了操作員,公司和患者的風險,所有這些都可能導致嚴重的負面影響。 生物的污染會導致生產設施長時間關閉,以進行必要的調查,查明根本原因并防止再次發生,這將延緩關鍵性救生藥物的生產和交付。
生物制藥生產過程中,不論是中間體還是最終產品的取樣對于生產至關重要。 除了通過生物負荷監測確保患者安全外,還需要進行取樣以支持由全球監管趨勢驅動的幾個關鍵必要事項,包括過程分析技術(PAT)和設計源于質量(QbD)(圖1)。
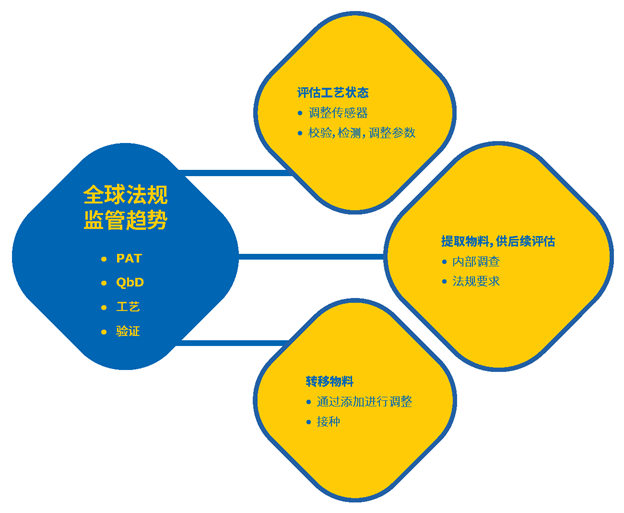
圖1.藥品生產工藝中取樣的的關鍵驅動力。
傳統取樣方法的局限性和風險
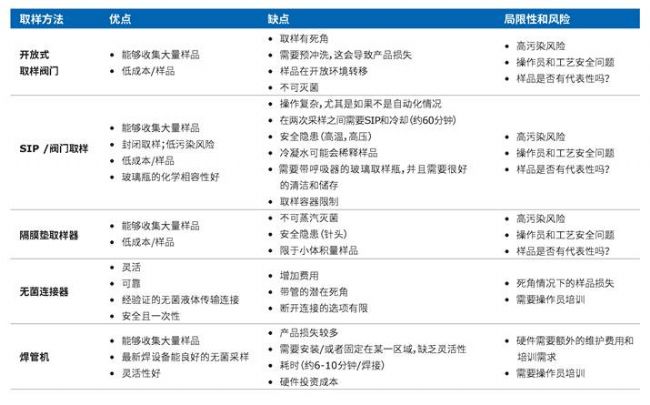
表2.與傳統采樣方法有關的優缺點摘要
封閉取樣
鑒于傳統采樣的缺點,許多生物制藥公司采用封閉的一次性采樣技術也就不足為奇了。封閉式設計可確保將樣品從樣品點到分析點很好的隔離,從而在保持樣品完整性的同時,降低了損失有價值產品的風險。
如圖2所示,與傳統方法相比,封閉的無菌過程采樣具有多個優點,包括易用性,更好地符合法規要求和有限的投資。
表3總結了封閉式取樣符合法規建議的具體方面,包括污染控制,操作員偏差的消除,收集代表性樣品的能力以及健康和安全的焦點。
鑒于傳統采樣的缺點,許多生物制藥公司采用封閉的一次性采樣技術也就不足為奇了。封閉式設計可確保將樣品從樣品點到分析點很好的隔離,從而在保持樣品完整性的同時,降低了損失有價值產品的風險。
如圖2所示,與傳統方法相比,封閉的無菌過程采樣具有多個優點,包括易用性,更好地符合法規要求和有限的投資。
表3總結了封閉式取樣符合法規建議的具體方面,包括污染控制,操作員偏差的消除,收集代表性樣品的能力以及健康和安全的焦點。

圖2.與傳統方法相比,一次性無菌取樣具有明顯優勢。

表3.無菌取樣符合特定的法規要求。
無菌取樣案例研究--病毒滅活的驗證
此案例研究舉例通過無菌取樣用于病毒滅活驗證,說明了封閉式取樣的價值。一家生物制藥公司,將病毒滅活作為細胞培養生產過程中的步驟,僅在驗證過程中通過動力學來驗證滅活。但是,FDA建議在驗證和生產過程中都需執行滅活動力學。病毒滅活每五到十分鐘最多需要15個樣品,而使用傳統CIP / SIP閥門和玻璃瓶進行取樣則不可能完成。最終選擇達到FDA的期望的解決方案,是基于封閉的60 mL PETG瓶以及將這些設備連接到罐子所需的合適的連接器,來實施無菌取樣。除了滿足法規要求外,藥企獲得的收益還包括質量控制(QC)實驗室中更快,更準確的取樣過程以及更輕松的樣品處理。
總結
沒有適當的采樣,就無法監控生物制藥生產過程。盡管存在許多取樣選擇,但并非所有方法都能很好地實現預期的收益或完全符合法規要求。選擇一種穩健且優化的方法,并實施適當的取樣計劃可確保符合法規要求,并能更好地進行流程和取樣管理。生物制藥業界越來越認識到封閉式取樣的價值,并利用許多優勢來保護生產工藝,操作員以及最終患者。
NovaSeptum®GO™無菌取樣
與SIP閥門/焊接等傳統方法相比,NovaSeptum®GO™無菌取樣系統的獨特技術可縮短樣品之間的周轉時間,同時最大程度地減少產品損失和污染風險(表4)。集成的安全功能可通過在不使用設備時將其鎖定并密封容器,從而在降低風險的策略上更加放心,確保樣品安全并控制過程。
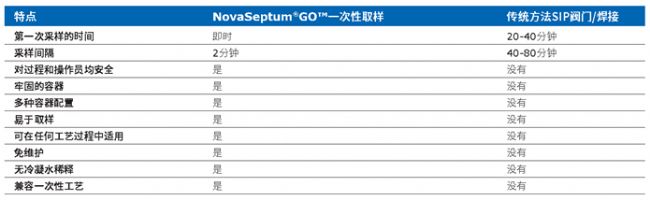
表4.無菌取樣可以縮短樣品之間的周轉時間,同時最大程度地減少產品損失和污染風險。
參考文獻
- EU Guidelines to Good Manufacturing Practice: Medicinal Products for Human and Veterinary Use; Annex 1 Manufacture of Sterile Medicinal Products. http://www.gmp-compliance.org/guidemgr/files/ ANNEX%2001[2008].PDF
- World Health Organization: Annex 4 WHO Guidelines for sampling of pharmaceutical products and related materials. http://apps.who.int/prequal/info_general/ documents/TRS929/WHO_TRS_929-Annex4.pdf
- FDA Guidance for Industry: CGMP for Phase I Investigational Drugs. http:// www.fda.gov/downloads/drugs/ guidancecomplianceregulatoryinformation/ guidances/ucm070273.pdf
- ICH Harmonised Tripartite Guideline: Good Manufacturing Practice Guide for Active Pharmaceutical Ingredients Q7. http://www.ich.org/ fileadmin/Public_Web_Site/ICH_Products/Guidelines/ Quality/Q7/Step4/Q7_Guideline.pdf
- Suvarna, et al. Case Studies of Microbial Contamination in Biologic Product Manufacturing. American Pharmaceutical Review. Jan 1, 2011. http://www.americanpharmaceuticalreview.com/ Featured-Articles/36755-Case-Studies-of-Microbial-Contamination-in-Biologic-Product-Manufacturing/
如需下載白皮書:從法規監管視角看制藥工藝中取樣的風險緩解,以及了解更多NovaSeptum®GO™無菌取樣,請點擊此處(https://app.askform.cn/18480060001.aspx)。
如您正在研發新冠病毒藥物,請點擊此處(https://app.askform.cn/18374910001.aspx)填寫問卷調查。我們會第一時間為您提供新冠藥物開發所涉及的產品技術與服務組合,及全球專家的優先支持。幫助您快速到達臨床,取得戰“疫”的勝利。
新冠病毒藥物研發默克聯系人:
史秋明博士 客戶技術應用總監
聯系方式:miles.shi@merckgroup.com
我們也將給您配備一對一的技術咨詢專家。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com