肝臟特異性TMEM16A敲除小鼠在發現治療非酒精性脂肪肝的新靶點的應用

非酒精性脂肪肝(Nonalcoholic fatty liver,NAFLD)是一種無過量飲酒史,但產生代謝應激性肝臟損傷的病癥,可從單純性脂肪肝進展為非酒精性脂肪性肝炎、肝纖維化和肝硬化,甚至肝癌、肝衰竭,是臨床上最常見、發病率逐年上升的慢性肝臟疾病。
目前認為NAFLD與肥胖、脂肪代謝紊亂、胰島素抵抗、糖尿病、低度炎癥反應等密切相關,是代謝綜合征的肝臟表現。通過增加膽固醇合成和脂肪酸合成相關基因的表達以及減少脂肪酸氧化相關基因的表達可促進非酒精性肝炎(NASH)進展,盡管這些過程有助于NASH的發生,但在NAFLD進展過程中的潛在機制尚不清楚。
近期,中山大學中山醫學院周家國教授課題組在Advanced Science雜志在線發表了題為“Hepatocyte TMEM16A Deletion Retards NAFLD Progression by Ameliorating Hepatic Glucose Metabolic Disorder“的文章,揭示了TMEM16A在NAFLD形成中的重要作用及機制,抑制肝TMEM16A或破壞TMEM16A / VAMP3相互作用可能為NAFLD的治療提供了新的潛在治療策略。

周家國教授課題組以及其它研究人員的大量研究表明,氯通道與多種代謝性疾病發生發展密切相關。氯離子通道的阻斷阻止了超氧陰離子自由基進入肝星狀細胞(HSC)并抑制了HSC的活化,HSC的活化對肝纖維化的發展至關重要。TMEM16A是Ca2 +激活Cl−通道(CaCC)的重要組成部分,盡管已證明肝細胞中存在CaCC,TMEM16A / CaCC在肝臟中的功能作用尚不清楚。
有意思的是,不論是高脂飲食誘導還是體外棕櫚酸刺激都能增加肝細胞TMEM16A表達以及CaCC電流幅度。患有NAFLD的患者和小鼠的肝組織中TMEM16A表達增加。肝臟中TMEM16A豐度的增加伴隨著NAFLD評分的增加,表明TMEM16A在肝脂肪變性中起重要作用。
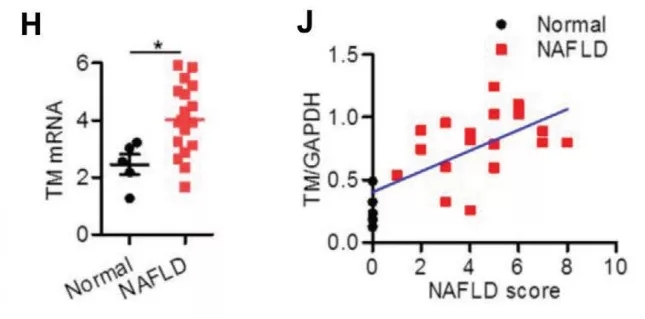
圖1. 正常個體與NAFLD患者肝臟TMEM16A mRNA的水平(H)。對人類受試者TMEM16A蛋白表達與NAFLD評分之間關系的Pearson相關性分析(J)。
研究人員委托賽業生物(cyagen)構建了肝臟特異性TMEM16A敲除小鼠(TMLKO),并投喂高脂飲食,結果小鼠體重與普通飲食組無差異 。與未缺失TMEM16A但投喂高脂飲食的小鼠相比,TMLKO小鼠的空腹血糖和胰島素抵抗指數都低,在糖耐試驗中表現較好。
反過來,過表達TMEM16A的轉基因小鼠(TMLTg)則惡化了脂肪肝誘導的肥胖和胰島素抵抗。PET/CT比較TMLKO和TMLTg小鼠的肝臟糖攝取,研究發現,盡管被投喂了高脂食物,TMLKO小鼠18氟脫氧葡萄糖(FDG)的增加比未敲除TMEM16A的對照組多,相反,TMLTg小鼠的18-FDG攝取和肝臟代謝活性都下降了。糖原異生酶mRNA表達分析顯示,TMEM16A過表達雖然抑制了GSK3β和FOXO1磷酸化,但是增強了糖原異生相關酶mRNA的表達。
進一步的機制研究表明,肝細胞TMEM16A與囊泡相關膜蛋白3(VAMP3)相互作用以誘導其降解,從而抑制了VAMP3 / syntaxin 4和VAMP3 /突觸體相關蛋白23′復合物的形成。這導致肝葡萄糖轉運蛋白2(GLUT2)易位和葡萄糖攝取受到損害。值得注意的是,VAMP3的過表達抑制了肝細胞TMEM16A在阻止GLUT2易位并促進脂質沉積、胰島素抵抗和炎癥中的功能。相比之下,VAMP3敲低可逆轉TMEM16A下調的有益作用。
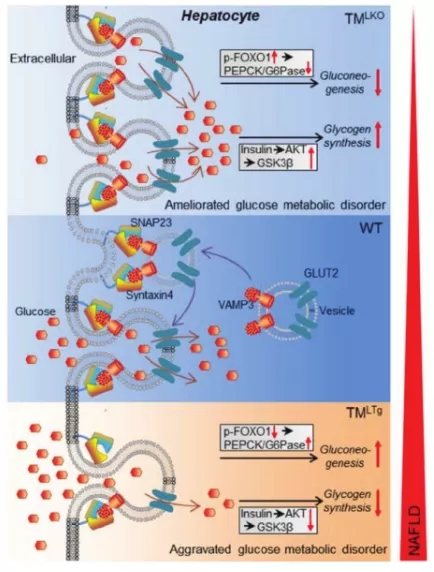
圖2. TMEM16A在NAFLD中的作用機制。
總而言之,這篇文章發現了TMEM16A參與的CaCC上調是NAFLD形成的重要機制,穩定的靶向肝細胞TMEM16A的小分子或阻斷TMEM16A / VAMP3相互作用的抑制劑可能是治療NAFLD的可行策略。
原文檢索:
Hepatocyte TMEM16A Deletion Retards NAFLD Progression by Ameliorating Hepatic Glucose Metabolic Disorder.
DOI: 10.1002/advs.201903657.
推薦閱讀





