APP完全性敲除小鼠和APP條件性敲除小鼠在阿爾茨海默病研究的應用

基因是很多人類疾病的內在因素,對疾病相關基因的研究是生命醫學研究領域的主流,如何快速了解研究疾病相關的基因以及這些基因的概況?一篇篇去讀文獻搜集篩選實在耗時耗力,為此,賽業生物的新欄目《Weekly gene》上線啦,每周二為您介紹一個基因,讓您每周快速了解一個基因,期待您的持續關注哦。今天我們要講的主角就是APP基因。
基因基本信息
1. 人類APP基因
基因位置:21號染色體(21q21.3)
全長:290kb,跨越18個外顯子
氨基酸范圍:639-770AA
保守性:線蟲,果蠅,所有脊椎動物
剪切產物:sAPPα, sAPPβ, Aβ, C83, C99, AICD, P3
細胞定位:膜蛋白
蛋白分子量:~87kd
主要蛋白氨基酸數量:770,695,751
家族基因:APLP1, APLP2
2. 小鼠APP基因
基因位置:16號染色體(16 C3.3;)
全長:222kb,跨越19個外顯子
敲除:長時程增強,學習記憶受影響。賽業紅鼠庫可提供APP完全性敲除小鼠和APP條件性敲除小鼠
過表達:長時程增強減弱
常用模型:5×FAD, 3×Tg, APP/PS1, APPswe
2. 大鼠APP基因
基因位置:11號染色體(11q11)
全長:217kb,跨越18個外顯子
敲除:無驗證數據
過表達:無信息
常用模型:APP21,APPKI, APPPS1
APP基因研究概況
APP編碼淀粉樣前體蛋白,其本身主要生理功能研究并未十分透徹,但其部分突變會導致Aβ產量的增加,或者Aβ更易聚集。Aβ的聚集(無論是寡聚體還是老年斑)會導致細胞鈣信號的紊亂和線粒體功能的失調,進而導致突觸的喪失和神經元的死亡,以及一系列神經炎癥的產生,這就是目前占據AD致病假說統治地位的Aβ假說。另有研究認為Aβ為AD副產物,在AD早期對神經元有保護作用。
通常情況下APP由ADAM10(一種α剪切酶)剪切,這種剪切會直接將Aβ攔腰截斷,因此也就杜絕了Aβ的產生;但當APP首先被BACE1剪切時,則有了產生Aβ的前提。在眾多家族性AD中APP突變可以大致分為三類,如果突變發生在β剪切酶切割位點(如swe等),會造成β剪切的增加;如果突變發生在γ剪切酶切割位點(如Flo,Lon等),也會導致Aβ表達的增加。如果突變發生在Aβ內部(如Iow,Dut等),則會通過改變Aβ的聚集能力誘發AD。此外,AD患病組織中也發現如IDE, NEP, ECE, ACE, MMP等參與Aβ清除的酶活性也發現有所降低。近年來,也有發現APP的部分突變能夠降低AD的發病概率。
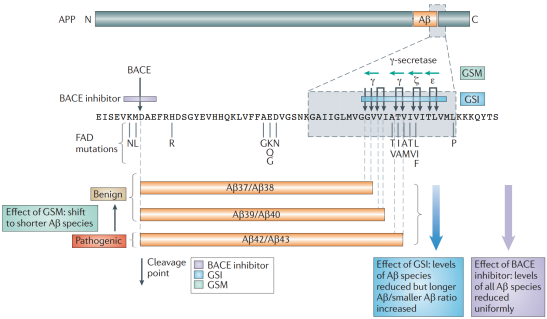
圖1. APP突變和剪切,圖片來源:推薦參考文獻1
阿爾茨海默病是世界上最常見的神經退行性疾病之一。臨床表現為細胞外淀粉樣斑塊和細胞內神經纖維纏結,導致神經元功能障礙和細胞死亡。Aβ影響鈣穩態,線粒體氧化應激、能量代謝和葡萄糖調節,最終導致神經細胞死亡。阿爾茨海默病的特征還包括存在神經纖維纏結。這些纏結是微管相關蛋白Tau過度磷酸化的結果。盡管其他激酶如PKC, PKA, Erk2也參與其中,但Tau的磷酸化主要是由GSK-3 和CDK5激酶造成的,。Tau蛋白的過磷酸化導致Tau蛋白從微管中分離,導致微管失穩和細胞內Tau蛋白的寡聚。神經纖維纏結是Tau齊聚的結果,并導致神經元凋亡。目前有研究發現Aβ的毒性是造成Tau過度磷酸化的元兇之一。
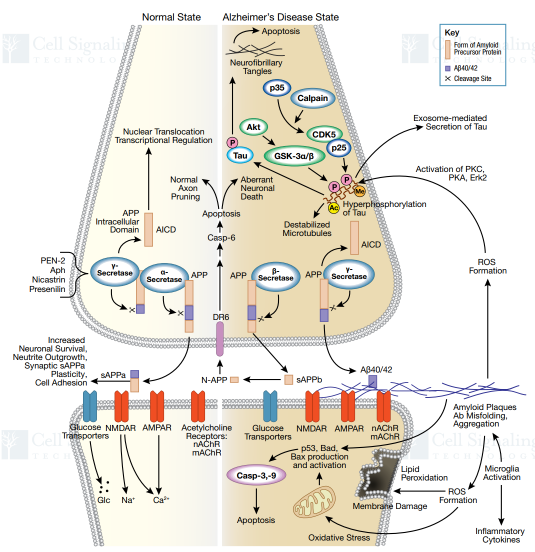
圖2. AD信號通路,圖片來源:Cell Signaling Technologyl
APP基因在人體組織的表達
APP在成年人的腦組織中高表達。此外在甲狀腺和腎中的表達量也很高。但在其他主要臟器及消化道組織中中表達豐度較低。
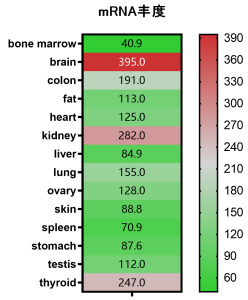
圖3:APP的表達,圖中數值為相對表達量,數據來源:NCBI。
推薦參考文獻:
[1] The amyloid cascade hypothesis for Alzheimer's disease: an appraisal for the development of therapeutics. Nat Rev Drug Discov 10, 698–712 (2011).
[2] Alzheimer's Disease Mechanisms and Emerging Roads to Novel Therapeutics[J]. Annual Review of Neuroence, 2016, 39(1):57.
[3] Christiane R . Alzheimer's Disease and the Amyloid Cascade Hypothesis: A Critical Review[J]. International Journal of Alzhmers Disease, 2012, 2012:369808.





