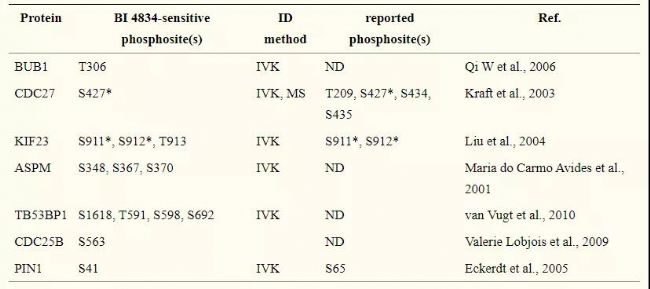
磷酸化蛋白組生信分析
Levene和Alsberg在1906年首次發現了蛋白的磷酸化,這個PTM在近30年后被定位到蛋白的絲氨酸殘基上(如圖1)。由于四個領域的平行發展:(i)二維凝膠電泳(2D-PAGE);(ii)質譜方法;(iii)蛋白數據庫;(iv)生物信息學工具,蛋白質組學研究在1990年代中期開始[1]。
最常見的蛋白質磷酸化包括與絲氨酸、蘇氨酸和酪氨酸的羥基側鏈形成磷酸酯鍵。兩種拮抗酶系統(激酶和磷酸酶)分別催化蛋白質磷酸化和去磷酸化[2]。磷酸化被分為四類:O-phosphorylation(pSer, pThr, pTyr), N-phosphorylation(pHis, pArg, pLys), phosphoanhydride(pAsp, pGlu) and phosphorothioate (pCys)(見圖2)[3]。
蛋白質磷酸化是許多細胞過程中的基本調節機制,磷酸化的異常擾動與各種人類疾病有關。因此,能夠對磷酸化蛋白質組進行全系統定量分析將為揭示感興趣的疾病的新信號通路、藥物靶點和生物標志物提供強大的推動力。

圖1 早期磷酸化研究簡史[1]
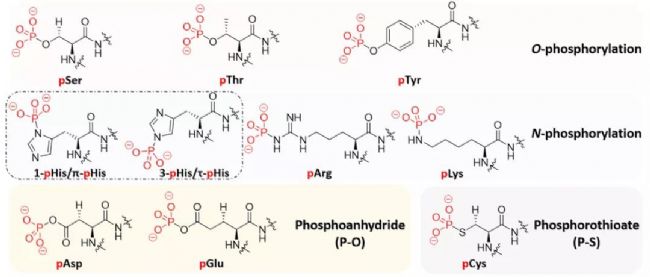
圖2 磷酸化修飾位點示意圖[3]
1.韋恩圖
不同處理組之間的共性和差異通常可以用韋恩圖展示[4]。BioVenn1能表現出不同組的元素數量以及相同點和不同點,同時展現數據集的大小。
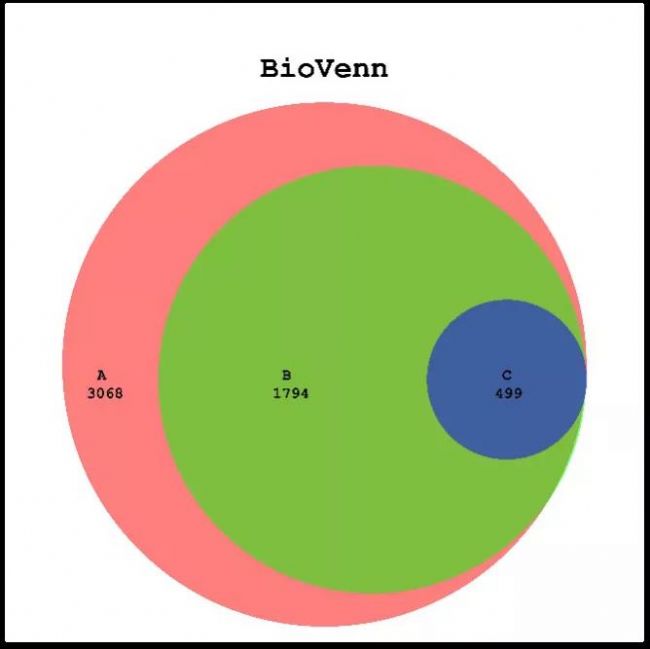
圖3 BioVenn-1
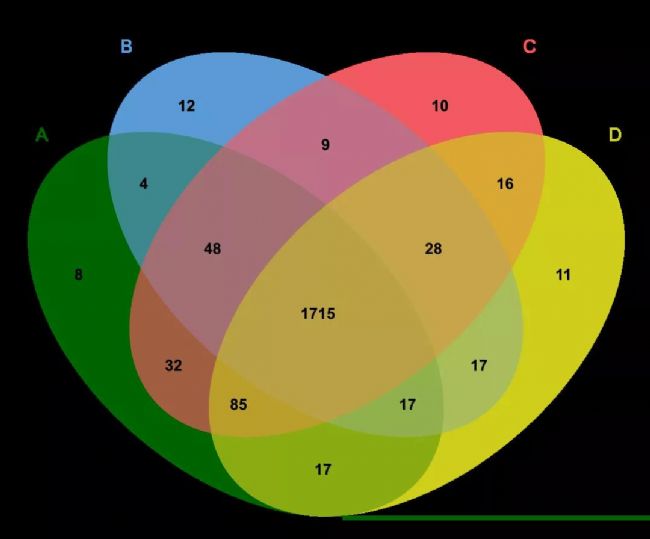
圖4 BioVenn-1
2.火山圖
在CHO-K1細胞適應無谷氨酰胺培養基的生長的實驗中,用火山圖來表示組間差異表達蛋白的表達量變化,閾值設置為fold change < 1.5和p value < 0.05[5](如Volcano Plot-1)。并在圖中標注TOP10差異表達蛋白。在實驗中,表達量高且顯著性高的差異蛋白是容易被關注的,并被選為目標蛋白。這也能降低后續的實驗難度。
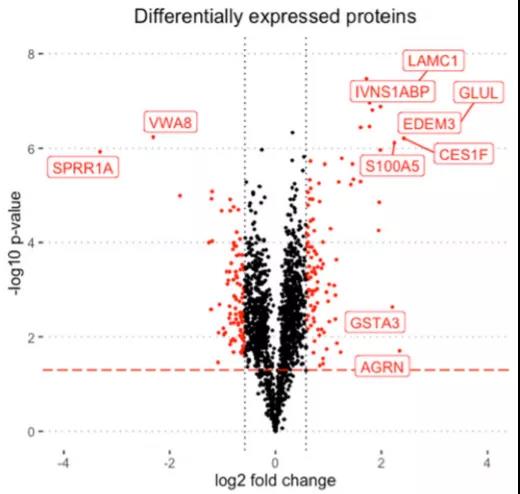
圖5 Volcano Plot-1[5]
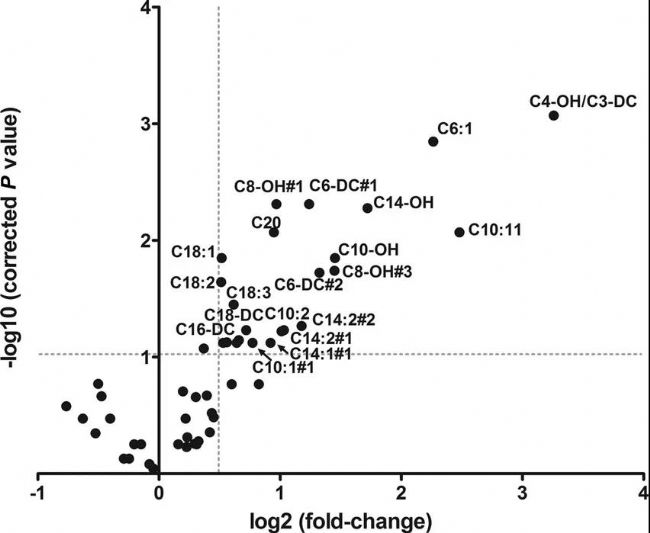
圖6 Volcano Plot-2[6]
3.KEGG Pathway分析
磷酸化水平晝夜規律波動的肝臟蛋白顯著富集在特定的代謝通路上,如胰島素相關代謝途徑、細胞自噬和晝夜節律相關的代謝途徑(如圖KEGG PATHWAY1-2),圖中橫坐標為富集程度Rich factor值,縱坐標表示矯正后的P-value值的大小,表明翻譯后修飾在晝夜節律調控中起著關鍵作用。
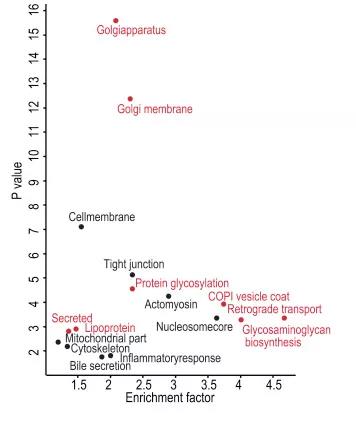
圖7 KEGG pathway-1[7]
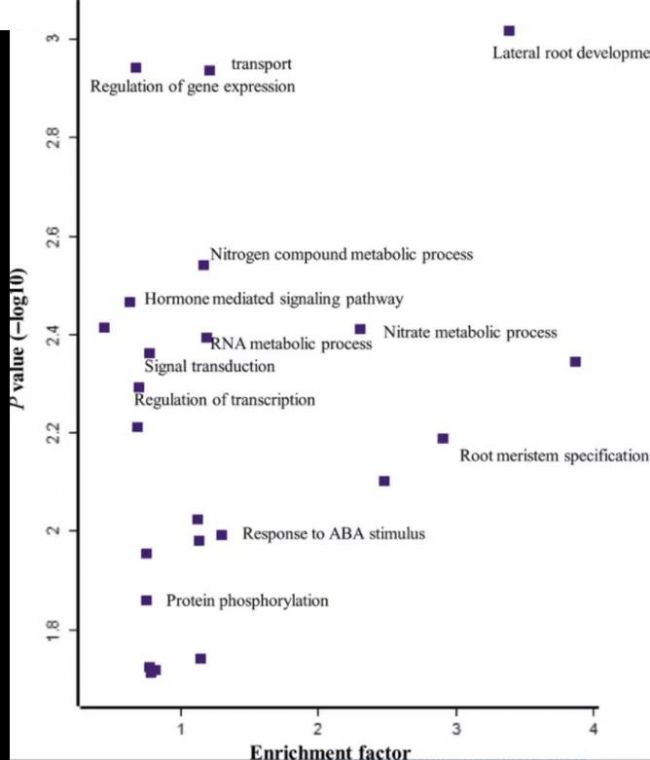
圖8 KEGG pathway-2[8]
4.GO分析
GO分析旨在發掘與基因差異表達現象關聯的單個特征基因功能類或多個特征功能類的組合。下面我們以辣椒的三個不同成長階段為例,以直方圖的形式展示了GO分析的結果。圖中橫坐標為映射差異表達蛋白的個數,縱坐標為GO Term。
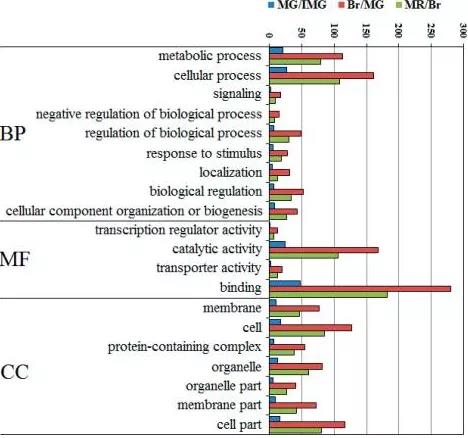
圖9 GO-1[9]
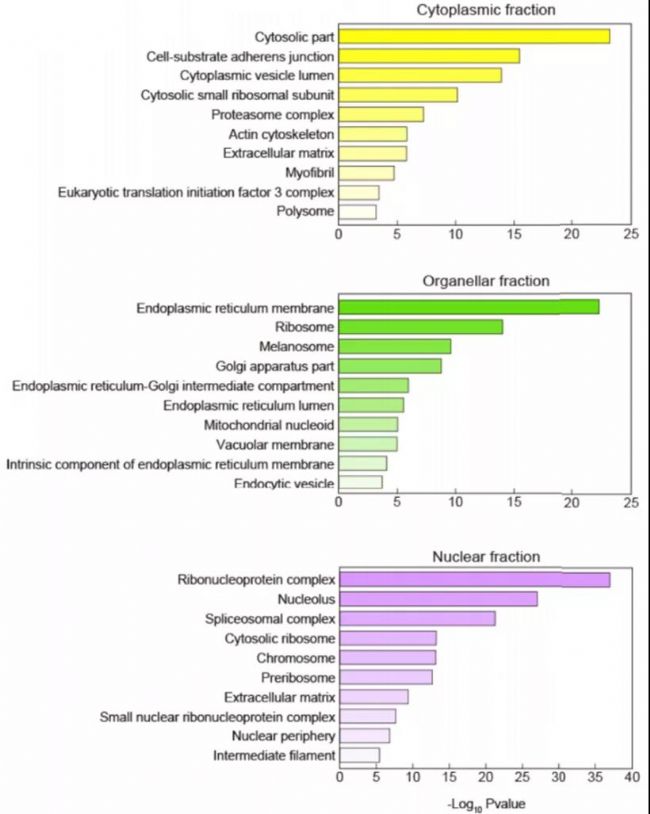
圖10 GO-2[10]

圖11 GO-3[8]
5.亞細胞定位
蛋白質必須轉運到其應在的亞細胞結構上才能行使其功能,否則就會出現機體功能紊亂,產生各種疾病。蛋白質的位置是蛋白質最重要的屬性之一,有助于確定蛋白質功能,揭示分子交互機理、理解復雜生理過程和開發藥物靶標等方面的研究。
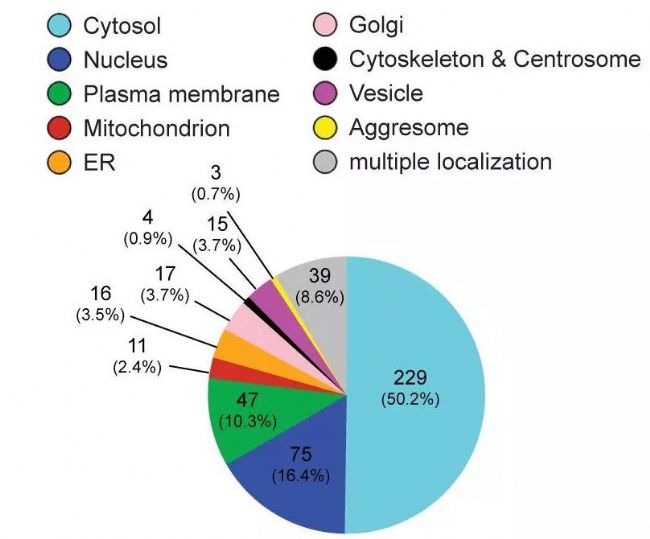
圖12 Subcellular Location[11]
6.PCA分析
主成分分析 (PCA, principal component analysis)是一種數學降維方法, 利用正交變換 (orthogonal transformation)把一系列可能線性相關的變量轉換為一組線性不相關的新變量(也稱為主成分),從而利用新變量在更小的維度下展示研究對象的特征。用少數幾個主成分的變化來近似代替原來多個變量的變化。通過主成分分析,可以反映不同樣本間的關系;對于大量樣本,通過離群點,判斷是否存在離散樣本,在進一步的分析中進行剔除。
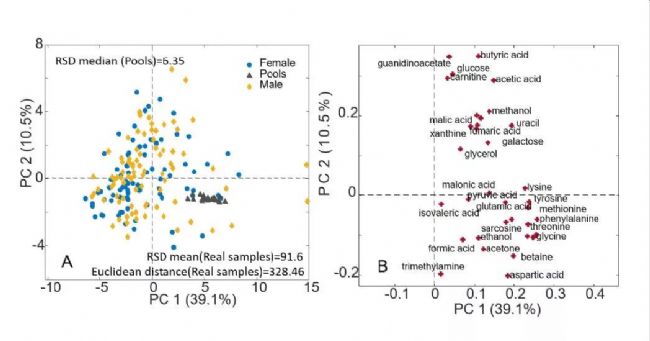 圖13 PCA[12]
圖13 PCA[12]
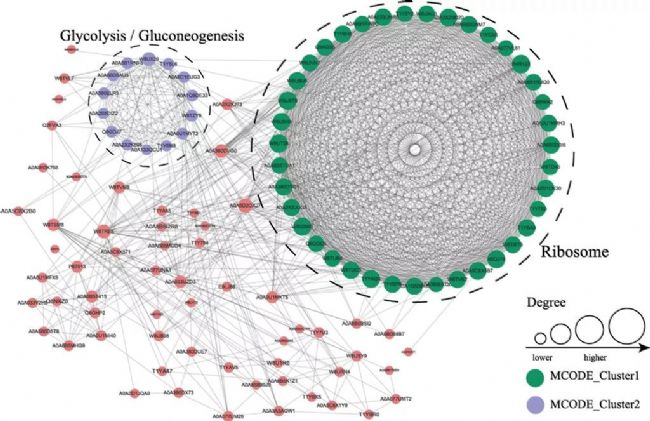
7.PPI分析
蛋白質-蛋白質相互作用網絡分析(Protein-Protein Interaction Network Analysis, PPI Network Analysis),是蛋白質組學的重要研究內容之一。蛋白質在行使生物功能時通過形成PPI網絡以維持時間和空間上的協調一致,構建差異表達蛋白的相互作用網絡,可以從蛋白質組層面發現差異表達蛋白的變化趨勢,進一步幫助我們尋找差異表達蛋白中的關鍵節點。

8.Motif分析
酶對特定底物的部分生化偏好可能是由修飾位點周圍的殘基決定的,這種蛋白或多肽序列形成的特定殘基模式稱為基序(Motif)在蛋白的同源序列中,不同位點的保守程度是不一樣的,一般來說,對蛋白質功能和結構影響比較大的位點會比較保守,其它位點則不是很保守。這些保守的位點就稱為“模體(motif)”。可以根據蛋白質序列特征(比如基于蛋白質基序)進行功能預測。
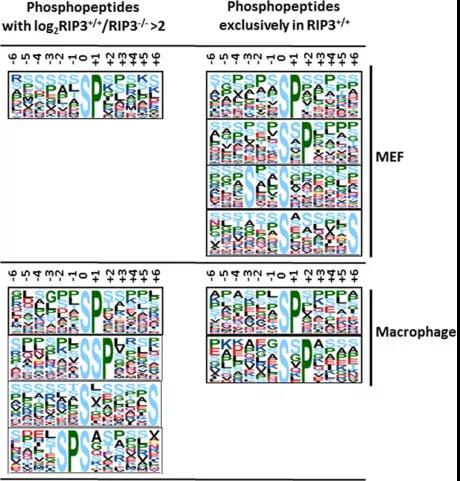
圖16 motif-1[15]

圖17 motif-2
9.激酶(kinase)預測分析
蛋白激酶(protein kinases,簡稱PK)。催化蛋白質磷酸化過程的酶。蛋白質的磷酸化過程是神經信息在細胞內傳遞的最后環節,導致離子通道蛋白及通道門的狀態變化。因此,激酶的變化與癌癥和疾病密切相關。在磷酸化蛋白組分析中,通常利用motif來預測激酶,揭示參與分子過程的參與者。常用預測激酶網站:http://hprd.org/PhosphoMotif_finder。
參考文獻
[1] Dupree, E.J., et al., A Critical Review of Bottom-Up Proteomics: The Good, the Bad, and the Future of this Field. Proteomes, 2020. 8(3).
[2] Kjeldsen, F., et al., On studying protein phosphorylation patterns using bottom-up LC-MS/MS: the case of human alpha-casein. Analyst, 2007. 132(8): p. 768-76.
[3] Huang, B., et al., NMR-based investigation into protein phosphorylation. Int J Biol Macromol, 2020. 145: p. 53-63.
[4] Panizza, E., et al., Isoelectric point-based fractionation by HiRIEF coupled to LC-MS allows for in-depth quantitative analysis of the phosphoproteome. Scientific Reports, 2017. 7(1): p. 4513.
[5] Kaushik, P., et al., LC-MS/MS-based quantitative proteomic and phosphoproteomic analysis of CHO-K1 cells adapted to growth in glutamine-free media. Biotechnology Letters, 2020. 42(12): p. 2523-2536.
[6] Ruiz M, Labarthe F, Fortier A, Bouchard B, Thompson Legault J, Bolduc V, Rigal O, Chen J, Ducharme A, Crawford PA, Tardif JC, Des Rosiers C. Circulating acylcarnitine profile in human heart failure: a surrogate of fatty acid metabolic dysregulation in mitochondria and beyond. Am J Physiol Heart Circ Physiol. 2017 Oct 1, 313(4).
[7] Krahmer N, Najafi B, Schueder F, et al. Uhlenhaut NH, Walther TC, Jungmann R, Zeigerer A, Borner GHH, Mann M. Organellar Proteomics and Phospho-Proteomics Reveal Subcellular Reorganization in Diet-Induced Hepatic Steatosis. Dev Cell. 2018 Oct 22;47(2): 205-221.
[8] Chen Y, Hoehenwarter W. Rapid and reproducible phosphopeptide enrichment by tandem metal oxide affinity chromatography: application to boron deficiency induced phosphoproteomics. Plant J. 2019 Apr;98(2):370-384.
[9] Liu Z, Lv J, Liu Y, Wang J, et al . Comprehensive Phosphoproteomic Analysis of Pepper Fruit Development Provides Insight into Plant Signaling Transduction. Int J Mol Sci. 2020 Mar 13;21(6).
[10] Masuda T, Sugiyama N, Tomita M, Ohtsuki S, Ishihama Y. Mass Spectrometry-Compatible Subcellular Fractionation for Proteomics. J Proteome Res. 2020 Jan 3;19(1):75-84.
[11] Zhang H, Cao X, Tang M, Zhong G, Si Y, Li H, Zhu F, Liao Q, Li L, Zhao J, Feng J, Li S, Wang C, Kaulich M, Wang F, Chen L, et al. A subcellular map of the human kinome. Elife. 2021 May 14;10:e64943.
[12] Cui Mengni,Trimigno Alessia,Aru Violetta,Rasmussen Morten A,Khakimov Bekzod,Engelsen Søren Balling. Influence of Age, Sex, and Diet on the Human Fecal Metabolome Investigated by 1H NMR Spectroscopy.[J]. Journal of proteome research,2021.
[13] Shi Y , Zhu J , Xu Y , et al. Malonyl-proteome profiles of Staphylococcus aureus reveal lysine malonylation modification in enzymes involved in energy metabolism[J]. Proteome Science, 2021,19(1).
[14] Li H , Y Zhang, Zhang J , et al. A quantitative proteomics analysis for small molecule Stemazole’s effect on human neural stem cells[J]. Proteome Science, 2020, 18(1).
[15] Wu X, Tian L, Li J, et al. Investigation of receptor interacting protein (RIP3)-dependent protein phosphorylation by quantitative phosphoproteomics. Mol Cell Proteomics. 2012 Dec;11(12):1640-51.
[16] Grosstessner-Hain K, Hegemann B, Novatchkova M, et al. Quantitative phospho-proteomics to investigate the polo-like kinase 1-dependent phospho-proteome. Mol Cell Proteomics. 2011, 10(11).