自噬與細胞周期調控的新機制
自噬,簡單來說就是細胞自己吃自己、廢物再利用。細胞陷于困境時 (如營養物質匱乏),啟動自噬程序自救,通過降解蛋白質和細胞器獲得必需的氨基酸、脂肪酸等營養物質維持基本生命活動,以便死中求生。一直以來,自噬都是生命科學領域的研究熱點。
2020 年 8 月 17 日,圖盧茲大學綜合生物研究中心 Arnaud Besson 教授團隊,在期刊 Nature cell biology 中發表的自噬相關文章 (圖 1),闡明了自噬與細胞周期調控的新機制。

背景介紹
p27Kip1 (p27) 被認為是細胞周期蛋白 CDK 的抑制因子,具有誘導細胞周期停滯的能力。營養匱乏往往是自噬發生的主要誘導原因,已有研究表明,細胞質中的 p27 是自噬的正調節劑 (葡萄糖匱乏或者血清剝奪的條件下),它可以保護細胞免受應激誘導的細胞凋亡。但是,p27 調控自噬作用的具體分子機制仍然是未知的。
接下來,M 君和大家一起來看看,關于自噬調控,作者團隊做了哪些精彩的工作。
p27 調控細胞自噬
作者團隊通過研究 p27+/+ MEFs 和 p27-/- MEFs 應對氨基酸剝奪后自噬的變化,證明了氨基酸缺乏的細胞中,p27 促進自噬。
細胞:
p27+/+ MEFs: p27 野生型 (p27+/+) 小鼠胚胎成纖維細胞 (MEFs),源于 p27 野生型小鼠胚胎。
p27+/+ MEFs: p27 缺失型 (p27-/-) MEFs,源于 p27 缺失的小鼠胚胎。
1、p27 促進自噬發生
LC3B-II 是自噬小體的標記物,位于自噬體膜,與溶酶體融合時被降解。氨基酸剝奪的短時間內,如圖 2a 所示,p27+/+ 和 p27-/- 小鼠胚胎成纖維細胞中,LC3B-II 表達水平相似,隨著氨基酸剝奪時間的延長,p27-/- 中的 LC3B-II 表達水平明顯會更高,并且在 48 小時表現出顯著統計學差異 (圖 2b)。在隨后的實驗中,選擇 48 小時作為氨基酸的長時間剝奪的誘導時間。圖 2c 的 LC3B 的免疫熒光染色同樣也呼應這一觀察結果 (紅色箭頭)。這表明 p27 可促進氨基酸剝奪細胞中的自噬。
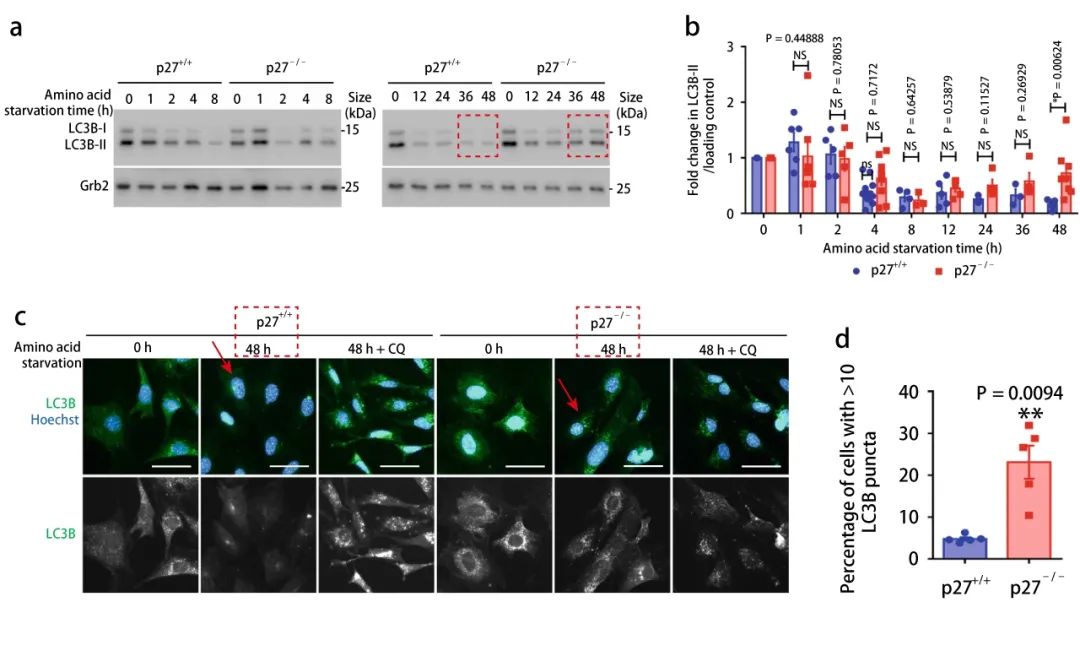
圖 2. 氨基酸剝奪不同時間,細胞中 LC3B,LC3B-I 和 LC3B-II 的表達【a-b: 指定時間段內氨基酸缺失的 p27+/+和 p27-/-MEFs 的 LC3B-I 和 LC3B-II 的表達和定量分析;c-d: p27+/+ 和 p27-/- MEFs 在 0 h 和氨基酸剝奪 48 h 后 LC3B(綠色熒光)免疫熒光染色和定量分析】
2、p27 調控自噬流的檢測
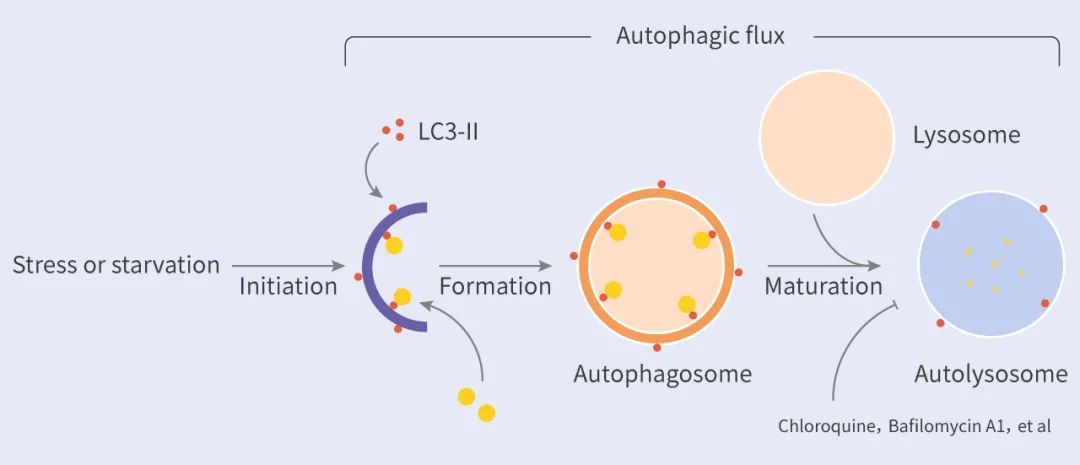
自噬是一個多步驟的動態過程,當應答營養匱乏的壓力時 (如氨基酸或葡萄糖缺乏),細胞接受自噬誘導信號,隨后會在胞漿處形成一種扁平的叫做吞噬泡 (Phagophore) 的雙層膜結構。緊接著,吞噬泡不斷延伸,包裹一些細胞元件或者自噬物 (Autophagic cargo),形成密閉的球狀的自噬小體 (Autophagosome)。自噬體與溶酶體融合形成自噬溶酶體 (Autolysosome),自噬體中的內容物被溶酶體中的酶降解,降解產生的營養物質會被細胞重新利用。
在整個過程中,細胞將自噬物吞噬到自噬小體,直到最后自噬溶酶體形成并降解自噬物的這個過程被稱為自噬流 (Autophagic flux) (圖 3)。自噬流中的任一環節出現障礙自噬都無法完成其生物學功能。
上文已經說到 LC3B-II 通常是自噬小體的 Marker,哺乳動物細胞內 LC3B 的總量通常不會有巨大波動,一般只會出現 LC3B-I 和 LC3B-II 間的相互轉換。
如果 LC3B-II 表達增加,可能是由于前期自噬活化后自噬小體增多導致的,也可能是后期自噬溶酶體清除失敗使其積累所致。因此,某單一時間點的 LC3B-II 的表達改變并不能體現自噬流的改變。
在文章中,使用了 WB 檢測蛋白、免疫熒光,mCherry-eGFP-LC3B 雙熒光系統的組合測量方法,檢測 p27+/+ 和 p27-/- MEFs 自噬流。
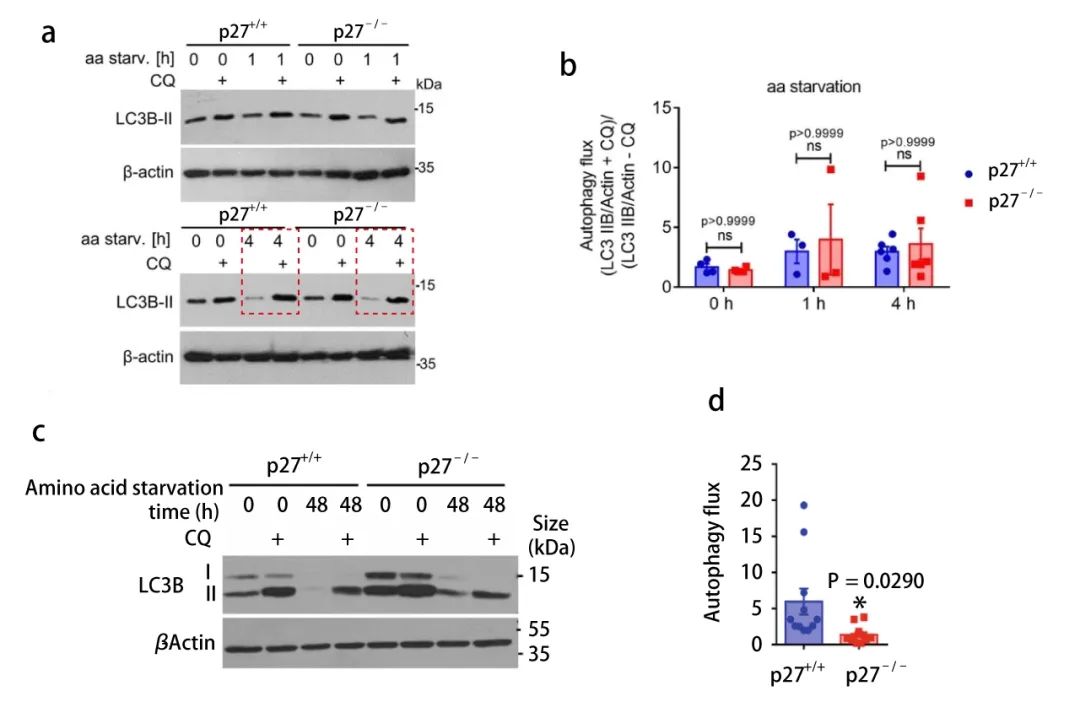
(1) 氯喹 (Chloroquine,CQ) 處理,檢測自噬流中 LC3B-II 變化
在酸性溶酶體中,氯喹會使溶酶體 pH 值升高,使溶酶體中酸性水解酶失活 ,從而抑制細胞內自噬溶酶體的融合與降解。氯喹處理細胞會導致 LC3B-II 的聚集,此時觀察到的 LC3B-II 的變化僅代表自噬小體數量的改變。
氯喹處理細胞后,在短期氨基酸剝奪的條件下 (0-4 h),兩種細胞的自噬通量是相似的 (圖 4a, b)。但是隨著時間的增加,長時間的氨基酸剝奪處理后,p27-/- MEFs 與 p27+/+ MEFs 相比,LC3B-II 數量顯著降低 (圖 4c, d)。這說明 p27 促進氨基酸缺失細胞中自噬通量。
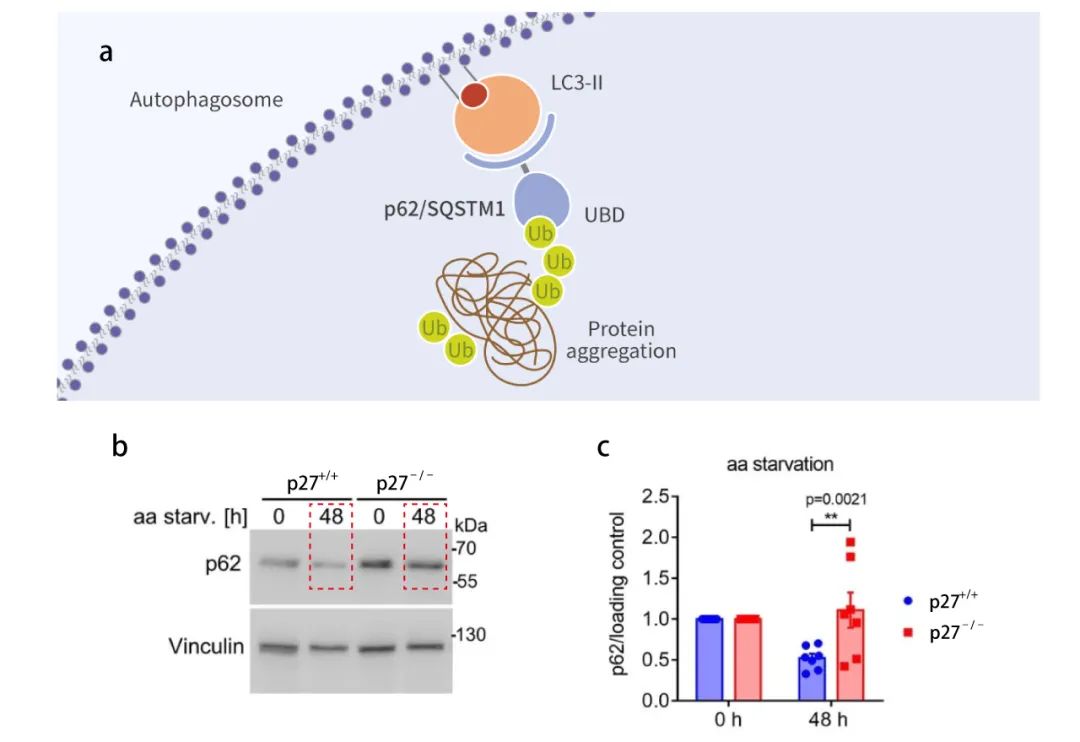
(2) p62/SQSTM1 在細胞中的積累
p62 也稱為 SQSTM1 蛋白,作為一種調節因子參與自噬體的構成,具有底物的特異性,是連接 LC3B-II 與待降解泛素化底物的橋梁。p62 結合泛素化蛋白進入到自噬體后最終與溶酶體融合形成自噬溶酶體從而得到清除 (圖 5a)。自噬流被抑制時,p62/SQSTM1 會在自噬流受損的細胞中積累, 在細胞內整體 p62 水平的表達與自噬活性存在負相關。
如圖 5 b 所示,隨著時間的增長,p62 在氨基酸缺乏的 p27-/- 細胞中的表達量更高,p27-/- 細胞的自噬流受損,這進一步說明了,p27 可以促進自噬流活化。
(3) mCherry-eGFP-LC3B 雙熒光系統檢測自噬體與自噬溶酶體。
mCherry (紅光)-eGFP (綠光)-LC3B 串聯熒光蛋白可用于檢測自噬流水平的融合蛋白。它利用了酸性自溶酶體和中性自噬體之間的 pH 差異以及不同熒光素對 pH 的敏感性差異,以監控從自噬體到自溶酶體的進程 (圖 6a)。
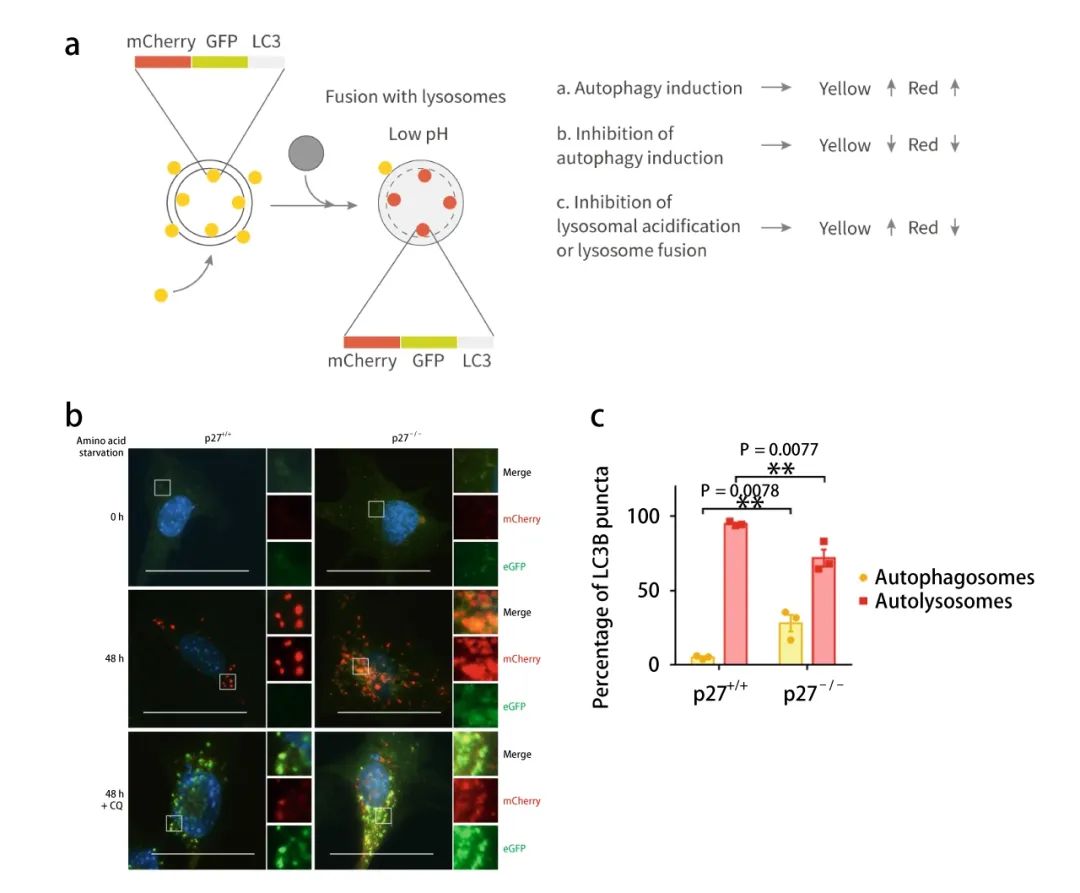
如圖 6a-b,mCherry 熒光基團的 pH 值穩定性比 GFP 高,GFP 熒光信號在進入溶酶體后由于 pH 值的下降會出現淬滅,而 mCherry 熒光基團進入溶酶體后仍能發出熒光。因此若細胞內出現綠和紅色熒光共定位,即出現黃色熒光時,表明:mCherry-eGFP-LC3B 融合蛋白并未與溶酶體發生融合, 說明了自噬流被阻斷。當細胞內僅出現紅色熒光而無綠色熒光時,代表 mCherry-eGFP-LC3B 融合蛋白定位于溶酶體或自噬溶酶體內,即自噬流活化。
與 p27+/+ 細胞相比,p27-/- 細胞中自噬溶酶體的比例下降 (72% vs 95%),進一步表明 p27 促進自噬流 (圖 6b-c)。
(4) p27 促進自噬體成熟
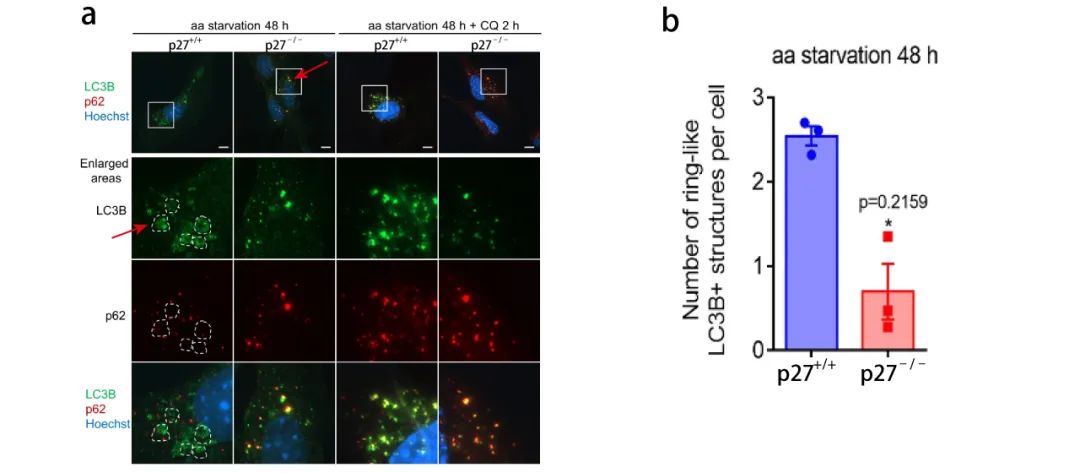
之前有文獻表明 (參考文獻 5),自噬體在成熟過程中,LC3B 陽性自噬囊泡會聚集在細胞核周圍形成環狀聚集結構,這種結構被認為是自噬體成熟過程中的中間結構。如圖 7a 所示,p27+/+ 細胞中有明顯的環狀聚集體,但是在 p27-/- 細胞中很少觀察到,取而代之的是小囊泡結構。這表明 p27 可促進自噬體成熟過程。
總結
1、在長期氨基酸剝奪的情況下,與 p27-/- 細胞相比,p27+/+ 小鼠胚胎成纖維細胞中 LC3B-II 的上調,p62 蛋白表達量減少,自噬溶酶體數目比例增加,以及自噬體成熟過程環狀聚集體的形成,可以證明 p27 在氨基酸長期匱乏的細胞中促進自噬流活化。
2、自噬流在細胞內是流動的細胞代謝過程, 自噬流中的任一環節出現障礙自噬將無法完成其生物學功能。尚無某種單一方法可以絕對準確特異的檢測自噬,因此應該使用組合的實驗方法來評估自噬活動 (自噬相關工具藥物的使用,WB 檢測自噬相關蛋白變化,免疫熒光共定位,以及 mCherry-eGFP-LC3B 雙熒光檢測等)。
3、足夠的實驗重復次數,合適的實驗對照,樂觀的心態也是實驗成功的必要因素,M 君祝大家開學伊始,實驗旗開得勝。
原文鏈接:DOI: 10.1038/s41556-020-0554-4.
2020 年 8 月 17 日,圖盧茲大學綜合生物研究中心 Arnaud Besson 教授團隊,在期刊 Nature cell biology 中發表的自噬相關文章 (圖 1),闡明了自噬與細胞周期調控的新機制。

圖 1. p27 調控自噬-溶酶體途徑,協調細胞周期和生長
背景介紹
p27Kip1 (p27) 被認為是細胞周期蛋白 CDK 的抑制因子,具有誘導細胞周期停滯的能力。營養匱乏往往是自噬發生的主要誘導原因,已有研究表明,細胞質中的 p27 是自噬的正調節劑 (葡萄糖匱乏或者血清剝奪的條件下),它可以保護細胞免受應激誘導的細胞凋亡。但是,p27 調控自噬作用的具體分子機制仍然是未知的。
接下來,M 君和大家一起來看看,關于自噬調控,作者團隊做了哪些精彩的工作。
p27 調控細胞自噬
作者團隊通過研究 p27+/+ MEFs 和 p27-/- MEFs 應對氨基酸剝奪后自噬的變化,證明了氨基酸缺乏的細胞中,p27 促進自噬。
細胞:
p27+/+ MEFs: p27 野生型 (p27+/+) 小鼠胚胎成纖維細胞 (MEFs),源于 p27 野生型小鼠胚胎。
p27+/+ MEFs: p27 缺失型 (p27-/-) MEFs,源于 p27 缺失的小鼠胚胎。
1、p27 促進自噬發生
LC3B-II 是自噬小體的標記物,位于自噬體膜,與溶酶體融合時被降解。氨基酸剝奪的短時間內,如圖 2a 所示,p27+/+ 和 p27-/- 小鼠胚胎成纖維細胞中,LC3B-II 表達水平相似,隨著氨基酸剝奪時間的延長,p27-/- 中的 LC3B-II 表達水平明顯會更高,并且在 48 小時表現出顯著統計學差異 (圖 2b)。在隨后的實驗中,選擇 48 小時作為氨基酸的長時間剝奪的誘導時間。圖 2c 的 LC3B 的免疫熒光染色同樣也呼應這一觀察結果 (紅色箭頭)。這表明 p27 可促進氨基酸剝奪細胞中的自噬。

圖 2. 氨基酸剝奪不同時間,細胞中 LC3B,LC3B-I 和 LC3B-II 的表達【a-b: 指定時間段內氨基酸缺失的 p27+/+和 p27-/-MEFs 的 LC3B-I 和 LC3B-II 的表達和定量分析;c-d: p27+/+ 和 p27-/- MEFs 在 0 h 和氨基酸剝奪 48 h 后 LC3B(綠色熒光)免疫熒光染色和定量分析】
2、p27 調控自噬流的檢測
自噬是一個多步驟的動態過程,當應答營養匱乏的壓力時 (如氨基酸或葡萄糖缺乏),細胞接受自噬誘導信號,隨后會在胞漿處形成一種扁平的叫做吞噬泡 (Phagophore) 的雙層膜結構。緊接著,吞噬泡不斷延伸,包裹一些細胞元件或者自噬物 (Autophagic cargo),形成密閉的球狀的自噬小體 (Autophagosome)。自噬體與溶酶體融合形成自噬溶酶體 (Autolysosome),自噬體中的內容物被溶酶體中的酶降解,降解產生的營養物質會被細胞重新利用。
在整個過程中,細胞將自噬物吞噬到自噬小體,直到最后自噬溶酶體形成并降解自噬物的這個過程被稱為自噬流 (Autophagic flux) (圖 3)。自噬流中的任一環節出現障礙自噬都無法完成其生物學功能。

圖 3. 細胞應答營養匱乏壓力時,自噬發生的示意圖[2]
【吞噬泡 (Phagophore)-自噬小體 (Autophagosome)-自噬溶酶體 (Autolysosome)】上文已經說到 LC3B-II 通常是自噬小體的 Marker,哺乳動物細胞內 LC3B 的總量通常不會有巨大波動,一般只會出現 LC3B-I 和 LC3B-II 間的相互轉換。
如果 LC3B-II 表達增加,可能是由于前期自噬活化后自噬小體增多導致的,也可能是后期自噬溶酶體清除失敗使其積累所致。因此,某單一時間點的 LC3B-II 的表達改變并不能體現自噬流的改變。
在文章中,使用了 WB 檢測蛋白、免疫熒光,mCherry-eGFP-LC3B 雙熒光系統的組合測量方法,檢測 p27+/+ 和 p27-/- MEFs 自噬流。
(1) 氯喹 (Chloroquine,CQ) 處理,檢測自噬流中 LC3B-II 變化
在酸性溶酶體中,氯喹會使溶酶體 pH 值升高,使溶酶體中酸性水解酶失活 ,從而抑制細胞內自噬溶酶體的融合與降解。氯喹處理細胞會導致 LC3B-II 的聚集,此時觀察到的 LC3B-II 的變化僅代表自噬小體數量的改變。
氯喹處理細胞后,在短期氨基酸剝奪的條件下 (0-4 h),兩種細胞的自噬通量是相似的 (圖 4a, b)。但是隨著時間的增加,長時間的氨基酸剝奪處理后,p27-/- MEFs 與 p27+/+ MEFs 相比,LC3B-II 數量顯著降低 (圖 4c, d)。這說明 p27 促進氨基酸缺失細胞中自噬通量。

圖 4. 氯喹影響細胞 LC3B-II 的表達
【a-b: p27+/+ 和 p27-/- MEFs 中,aa-剝奪 0 h、1 h、4 h 后 (有或無氯喹處理) , LC3B-II 的表達和不同細胞中自噬流變化的定量分析 (LC3B-II+CQ/actin)/(LC3B-II-CQ/actin);c-d: aa-剝奪 0 h、48 h 后,LC3B-II 的表達和自噬流變化的定量分析】(2) p62/SQSTM1 在細胞中的積累
p62 也稱為 SQSTM1 蛋白,作為一種調節因子參與自噬體的構成,具有底物的特異性,是連接 LC3B-II 與待降解泛素化底物的橋梁。p62 結合泛素化蛋白進入到自噬體后最終與溶酶體融合形成自噬溶酶體從而得到清除 (圖 5a)。自噬流被抑制時,p62/SQSTM1 會在自噬流受損的細胞中積累, 在細胞內整體 p62 水平的表達與自噬活性存在負相關。
如圖 5 b 所示,隨著時間的增長,p62 在氨基酸缺乏的 p27-/- 細胞中的表達量更高,p27-/- 細胞的自噬流受損,這進一步說明了,p27 可以促進自噬流活化。

圖 5. p62 在自噬流受損的細胞中積累
【a: p62 參與自噬體的構成[3];b: aa-剝奪 0 h 或 48 h,p62 和 Vinculin (Loading control) WB 結果;c: p62 歸一化的定量分析。】(3) mCherry-eGFP-LC3B 雙熒光系統檢測自噬體與自噬溶酶體。
mCherry (紅光)-eGFP (綠光)-LC3B 串聯熒光蛋白可用于檢測自噬流水平的融合蛋白。它利用了酸性自溶酶體和中性自噬體之間的 pH 差異以及不同熒光素對 pH 的敏感性差異,以監控從自噬體到自溶酶體的進程 (圖 6a)。

圖 6. 串聯熒光探針及熒光共定位檢測自噬流
【a: mCherry-eGFP-LC3B 串聯熒光探針示意圖與機制[6];b: p27+/+ 和p27-/- MEFs 中,0 h 或 aa-剝奪 48 h 時,mCherry-eGFP-LC3B 示蹤自噬體以及與自噬溶酶體形成;c: 自噬小體 (黃色) 和自噬溶酶體 (紅色) 的定量分析】如圖 6a-b,mCherry 熒光基團的 pH 值穩定性比 GFP 高,GFP 熒光信號在進入溶酶體后由于 pH 值的下降會出現淬滅,而 mCherry 熒光基團進入溶酶體后仍能發出熒光。因此若細胞內出現綠和紅色熒光共定位,即出現黃色熒光時,表明:mCherry-eGFP-LC3B 融合蛋白并未與溶酶體發生融合, 說明了自噬流被阻斷。當細胞內僅出現紅色熒光而無綠色熒光時,代表 mCherry-eGFP-LC3B 融合蛋白定位于溶酶體或自噬溶酶體內,即自噬流活化。
與 p27+/+ 細胞相比,p27-/- 細胞中自噬溶酶體的比例下降 (72% vs 95%),進一步表明 p27 促進自噬流 (圖 6b-c)。
(4) p27 促進自噬體成熟

圖 7. p27 促進自噬體成熟過程的中間體形成
【a: p27+/+ 和 p27-/- MEFs 中,0 h 或 aa-剝奪 48 h 時, LC3B 和 p62 的免疫染色 (虛線描繪了 LC3B 陽性環狀結構);b: p27+/+ 和p27-/- MEFs 中 LC3B 環狀聚集物的定量。】 之前有文獻表明 (參考文獻 5),自噬體在成熟過程中,LC3B 陽性自噬囊泡會聚集在細胞核周圍形成環狀聚集結構,這種結構被認為是自噬體成熟過程中的中間結構。如圖 7a 所示,p27+/+ 細胞中有明顯的環狀聚集體,但是在 p27-/- 細胞中很少觀察到,取而代之的是小囊泡結構。這表明 p27 可促進自噬體成熟過程。
總結
1、在長期氨基酸剝奪的情況下,與 p27-/- 細胞相比,p27+/+ 小鼠胚胎成纖維細胞中 LC3B-II 的上調,p62 蛋白表達量減少,自噬溶酶體數目比例增加,以及自噬體成熟過程環狀聚集體的形成,可以證明 p27 在氨基酸長期匱乏的細胞中促進自噬流活化。
2、自噬流在細胞內是流動的細胞代謝過程, 自噬流中的任一環節出現障礙自噬將無法完成其生物學功能。尚無某種單一方法可以絕對準確特異的檢測自噬,因此應該使用組合的實驗方法來評估自噬活動 (自噬相關工具藥物的使用,WB 檢測自噬相關蛋白變化,免疫熒光共定位,以及 mCherry-eGFP-LC3B 雙熒光檢測等)。
3、足夠的實驗重復次數,合適的實驗對照,樂觀的心態也是實驗成功的必要因素,M 君祝大家開學伊始,實驗旗開得勝。
原文鏈接:DOI: 10.1038/s41556-020-0554-4.
| 相關化合物 | |
| ChloroquineChloroquine phosphate | Autophagy 和 Toll-like receptors (TLRs) 的抑制劑。 |
| Bafilomycin A1 | 抑制自噬 (Autophagy) 且誘導凋亡 (Apoptosis)。 |
| Hoechst 33342 | 發藍色熒光的 DNA 染料,可以透過細胞膜。 |
| E64d | 溶酶體蛋白酶抑制劑,可用于自噬流檢測。 |
| Leupeptin | 溶酶體蛋白酶抑制劑,可用于自噬流檢測。 |
| Pepstatin A | 溶酶體蛋白酶抑制劑,可用于自噬流檢測。 |
| 自噬激活劑 | 包含 Rapamycin,MG-132 等 600+ 種有效的自噬激活劑。 |
| 自噬抑制劑 | 包含 3-Methyladenine (3-MA) ,Resatorvid (TAK-242) 等近 200 種有效的自噬抑制劑。 |
| 自噬化合物庫 | 收錄了 900+ 種自噬信號通路相關的產品,是研究自噬相關調控及疾病的有用工具。 |
標簽:
細胞程序性死亡
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





