腫瘤的特征和腫瘤代謝的分類
腫瘤是一種由原癌基因或抑癌基因突變引起的成因復雜的疾病,是導致人類死亡的主要疾病之一。Hanahan 和 Weinberg 于 2000 提出,腫瘤的主要特征包括持續增殖 (Sustained proliferative signaling)、逃避生長抑制因子 (Evasionof growth suppressors)、抗凋亡 (Resistance to cell death)、無限復制潛能 (Replicative immortality)、血管生成 (Angiogenesis)、轉移和侵襲能力 (Activation of invasion and metastasis)。隨著腫瘤發生、發展的分子機制不斷得到闡明,Hanahan 和 Weinberg 又于 2011 年將免疫逃逸 (Immune destruction) 和代謝重編程 (Reprogramming of energy metabolism/Metabolic reprogramming) 這兩種現象歸納為腫瘤細胞的主要特征。
機體代謝包括糖代謝、脂代謝、蛋白質/氨基酸代謝、核苷酸/核酸代謝以及其他營養物質代謝。各種物質代謝相互聯系,相互影響,代謝信號通路相互作用形成了復雜的代謝網絡。腫瘤細胞的代謝模式與正常細胞有很大不同。腫瘤代謝重編程
癌癥代謝重編程是指癌細胞重新編程某些新陳代謝的現象。一方面,癌癥代謝重編程通過促使快速增殖、存活、侵襲、轉移、抗治療和其他中央細胞促腫瘤過程,以促進腫瘤發生。另一方面,隨著腫瘤的發展,癌細胞獲得更多突變和改變,進一步增強代謝重編程,從而又反過來加速腫瘤的生長、增殖和發展。
癌癥代謝重編程的主要特征是糖酵解、谷氨酰胺分解、脂質代謝、線粒體生物生成、磷酸戊糖途徑以及其他生物合成和生物能量途徑的上調 (圖 1)。
抑癌基因 (Tumor suppressors) 和癌基因 (Oncogenes) 之間的平衡對癌癥代謝狀態有決定性影響。癌基因如 c-Myc、HIF-1、Ras 和 PI3K/Akt 是腫瘤代謝改變的重要促進因素,而 p53、LKB1/AMPK 等主要抑癌基因則能拮抗這些變化,控制細胞代謝。
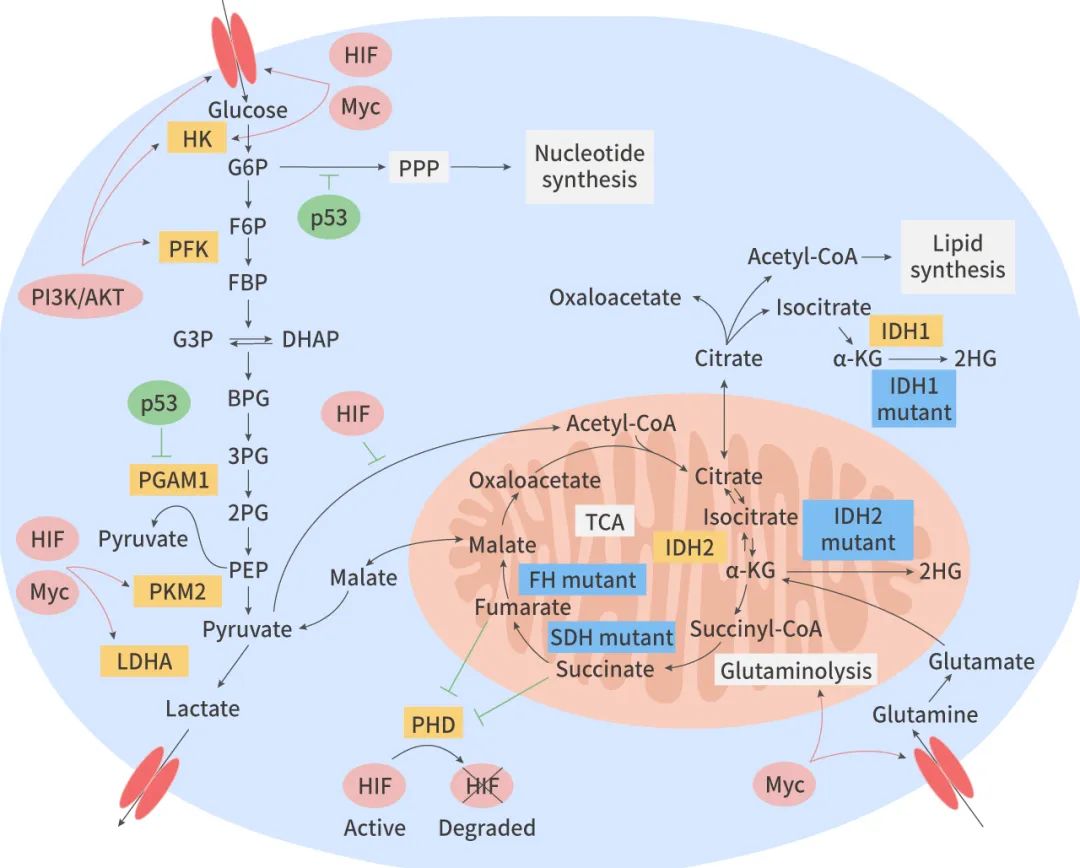
瓦博格效應目前已經受到了腫瘤生物學的廣泛關注,與之相關的很多分子都成為了抗腫瘤藥物研發的熱門靶點。例如己糖激酶 2 (HK2) ,其抑制劑 3-BrPA (3-bromopyruvate) ,能夠抑制有氧糖酵解和氧化磷酸化,具有成為抗腫瘤藥物的潛力;乳酸脫氫酶 A (LDHA,由 c-Myc 和缺氧誘導因子 HIF-1 的靶基因編碼) ,其抑制劑 FX11,可誘導癌細胞氧化應激和死亡,抑制腫瘤發展;糖酵解的限速酶 GLUT1 (葡萄糖轉運蛋白家族成員,受 HIF-1 調控),其抑制劑 WZB117 具有抗腫瘤活性。
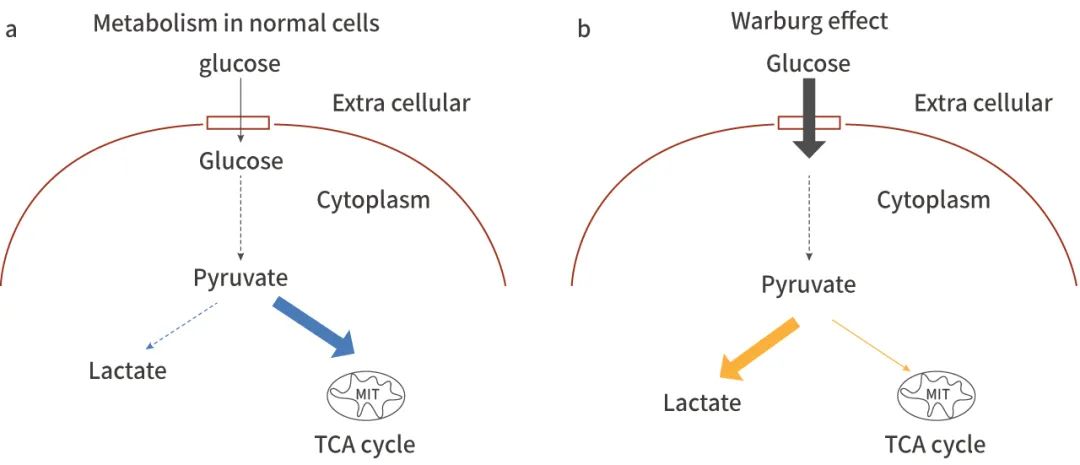
圖 2. 瓦博格效應的示意圖[8]
正常供氧情況下,在正常細胞中 (a),大部分丙酮酸進入三羧酸 (TCA) 循環,代謝成為二氧化碳和水。在癌細胞中 (b) ,大部分丙酮酸用于乳酸合成。在癌細胞的葡萄糖攝取率比正常細胞高
除了抗腫瘤靶向藥物研究,癌癥的糖代謝特征也被應用于影像診斷,例如 18FDG-PET 掃描,就是基于葡萄糖類似物示蹤劑 18FDG 在腫瘤細胞中的代謝作用。
氨基酸/谷氨酰胺代謝
腫瘤活躍的增殖活動需要源源不斷的氨基酸用于合成結構蛋白和功能蛋白。此外,腫瘤細胞旺盛的物質需求和眾多生化反應也需要大量的氨基酸支持。
氨基酸分為必須氨基酸和非必須氨基酸,前者需要從食物中獲取,而后者可以靠細胞自身合成。據報道,多種腫瘤細胞中存在氨基酸依賴的現象:即腫瘤細胞喪失了合成某種非必須氨基酸的能力,需要額外的供給。例如,很多乳腺癌及肺癌細胞系需要額外供應谷氨酰胺才能生長。谷氨酰胺是一種非必須氨基酸,在細胞內可以分解為 α-酮戊二酸 (α-KG)。α-KG 是 TCA 循環的中間產物。TCA 循環不僅可以為細胞提供大量 ATP,還為大分子合成提供前體物質,例如為糖異生提供蘋果酸、為氧化磷酸化提供 NADH、為亞鐵血紅素合成提供琥珀酰 CoA。鑒于谷氨酰胺在能量生成和大分子合成中發揮了關鍵作用,針對谷氨酰胺代謝相關的酶類 (如 SLC1A5) 開發的相關藥物在抑制腫瘤方面具有非常大的潛力。
脂質和核酸代謝
除了糖類和氨基酸代謝之外,腫瘤細胞中的脂質和核酸代謝可以為腫瘤治療提供新思路。脂類是細胞膜和其他細胞器膜的基本組成成分,脂類維持了細胞膜的流動性,并且對細胞膜上的信號轉導相關分子 (受體、酶等) 的激活極為重要。多數腫瘤細胞具有從頭合成脂肪酸的能力,以持續合成新的膜結構。在這個過程中,乙酰輔酶 A 羧化酶 (ACC) 和脂肪酸合成酶 (FASN) 具有關鍵作用,是潛在的腫瘤治療靶點。核苷酸是核酸的基本結構單位,細胞內的游離核苷酸是代謝中極為重要的物質,幾乎參加了細胞內所有的生化過程。腫瘤細胞的核苷酸代謝通路中的一些關鍵酶也可以成為抗腫瘤藥物靶點。乳酸/H+代謝與腫瘤微環境
腫瘤的代謝是復雜的,代謝表型可能同時反映了腫瘤細胞的內在特性以及腫瘤細胞與腫瘤微環境 (TME) 之間的相互作用。
腫瘤細胞釋放的乳酸是維持癌癥酸性表型的重要因素,并且通過調節 TME 促進細胞遷移、侵襲、血管生成以及逃避免疫監視等腫瘤發展的特征。在黑色素瘤中,乳酸通過單羧酸轉運蛋白 4 (MCT4) 分泌到 TME 中,導致免疫抑制和血管生成,促進腫瘤發展。乳酸還抑制 CD8+ T 細胞的增殖和功能,阻止樹突狀細胞成熟,并將 M1 巨噬細胞轉化為 M2 巨噬細胞。此外,乳酸還通過增加內皮細胞 IL-8 和 VEGF 信號傳遞促進血管生成。色氨酸 (Tryptophan) 代謝通過色氨酸的消耗以及向 TME 分泌犬尿氨酸 (Kynurenine) 進一步促進了免疫抑制。質子轉運激活組織蛋白酶和基質金屬蛋白酶 (MMPs) 對 TME 進行酸化,酸化的 TME 又通過細胞外基質的降解促進腫瘤遷移和轉移 (圖 3)。
除腫瘤之外,物質代謝紊亂還跟許多慢性疾病的發生或發展密切相關,如糖尿病、肥胖、心血管疾病等。針對代謝相關疾病的基礎研究和藥物研發也變得越來越重要。
| 相關化合物庫 | 作用 |
| 代謝/蛋白酶化合物庫 | MCE 收錄了 1800+ 種代謝/酶相關的小分子化合物,是代謝相關疾病藥物研發的有力工具。 |
| 糖酵解化合物庫 | MCE 提供 300+ 個糖酵解相關化合物,主要靶向糖酵解過程中的一些關鍵酶,如 hexokinase,glucokinase,enolase,pyruvate kinase,PDHK 等,是研究糖代謝及抗腫瘤藥物開發的有用工具。 |
| 谷氨酰胺代謝化合物庫 | MCE 收錄了 300+ 個靶向谷氨酰胺代謝通路中主要蛋白和酶的小分子化合物,是研究谷氨酰胺代謝進程的有用工具。 |
縮寫:
HK2: Hexokinase 2;
LDHA: Lactate dehydrogenase A;
GLUT1: Glucose transporter 1;
HIF-1: Hypoxia-inducible factor;
TCA cycle: Tricarboxylic acid cycle;
FDG-PET: Fluorodeoxyglucose-positron emission tomography;
α-KG: α-Ketoglutarate;
CoA: Coenzyme A;
SLC1A5: Solute carrier family 1 member 5;
ACC: Acetyl-CoA carboxylase;
FASN: Fatty acid synthase;
TME: Tumor microenvironment;
MCT4: Monocarboxylate transporter 4;
MMPs: Matrix metalloproteases
參考文獻
1. Douglas Hanahan, et al. The Hallmarks of Cancer. Cell, 2000. 100: p. 57–70.
2. Hanahan, D., et al. Hallmarks of Cancer: The Next Generation. Cell, 2011. 144(5): p. 646-674.
3. Vernieri, C., et al. Targeting Cancer Metabolism: Dietary and Pharmacologic Interventions. Cancer Discovery,2016. 6(12): p. 1315-1333.
4. Haoyang Li, et al. CaMeRe: A Novel Tool for Inference of Cancer Metabolic Reprogramming. Front Oncol. 2020Feb 25;10:207.
5. Liem Minh Phan, et al. Cancer metabolic reprogramming: importance, main features, and potentials for precisetargeted anti-cancer therapies. Cancer Biol Med. 2014 Mar; 11(1): 1-19.
6. Tengjiao Fan, et al. Tumor Energy Metabolism and Potential of 3-Bromopyruvate as an Inhibitor of AerobicGlycolysis: Implications in Tumor Treatment. Cancers (Basel). 2019 Mar; 11(3):317.
7. Anne Le, et al.Inhibition of lactate dehydrogenase A induces oxidative stress and inhibits tumorprogression. Proc Natl Acad Sci U S A. 2010 Feb 2;107(5):2037-42.
8. Kareenhalli V. Venkatesh, et al. Encyclopedia of Systems Biology.. In: Dubitzky W., Wolkenhauer O., Cho KH.,Yokota H. (eds) Encyclopedia of Systems Biology. Springer, New York, NY. 2013.
9. Bhaskar Bhattacharya, et al. The Warburg Effect and Drug Resistance. Br J Pharmacol. 2016 Mar;173(6):970-9.
10. Nuno Santos, et al. Lactate as a Regulator of Cancer Inflammation and Immunity. Immunometabolism.2019;1:e190015.
11. Grant M. Fischer, et al. Metabolic Strategies of Melanoma Cells: Mechanisms, Interactions With the Tumor Microenvironment, and Therapeutic Implications. Pigment Cell Melanoma Res. 2018Jan; 31(1): 11–30.
12. Kathleen A Vermeersch, et al. Applications of Metabolomics in Cancer Researchtt. J Carcinog. 2013 Jun18;12:9.
13. Chi V Dang, et al. Therapeutic targeting of cancer cell metabolism. J Mol Med (Berl). 2011 Mar;89(3):205-12.





