腫瘤微環境在癌癥中的作用
在過去數十年中,通過使用免疫療法、靶向療法和聯合方案,癌癥治療領域取得了很大的進步。但這些治療方案中的絕大多數最終都無法治愈患者,甚至對治療有顯著初始反應的腫瘤也經常復發為耐藥惡性腫瘤。另一方面,越來越多的證據表明,腫瘤微環境 (TME) 在腫瘤進展中發揮關鍵作用,如局部耐藥、免疫逃逸和癌癥轉移。
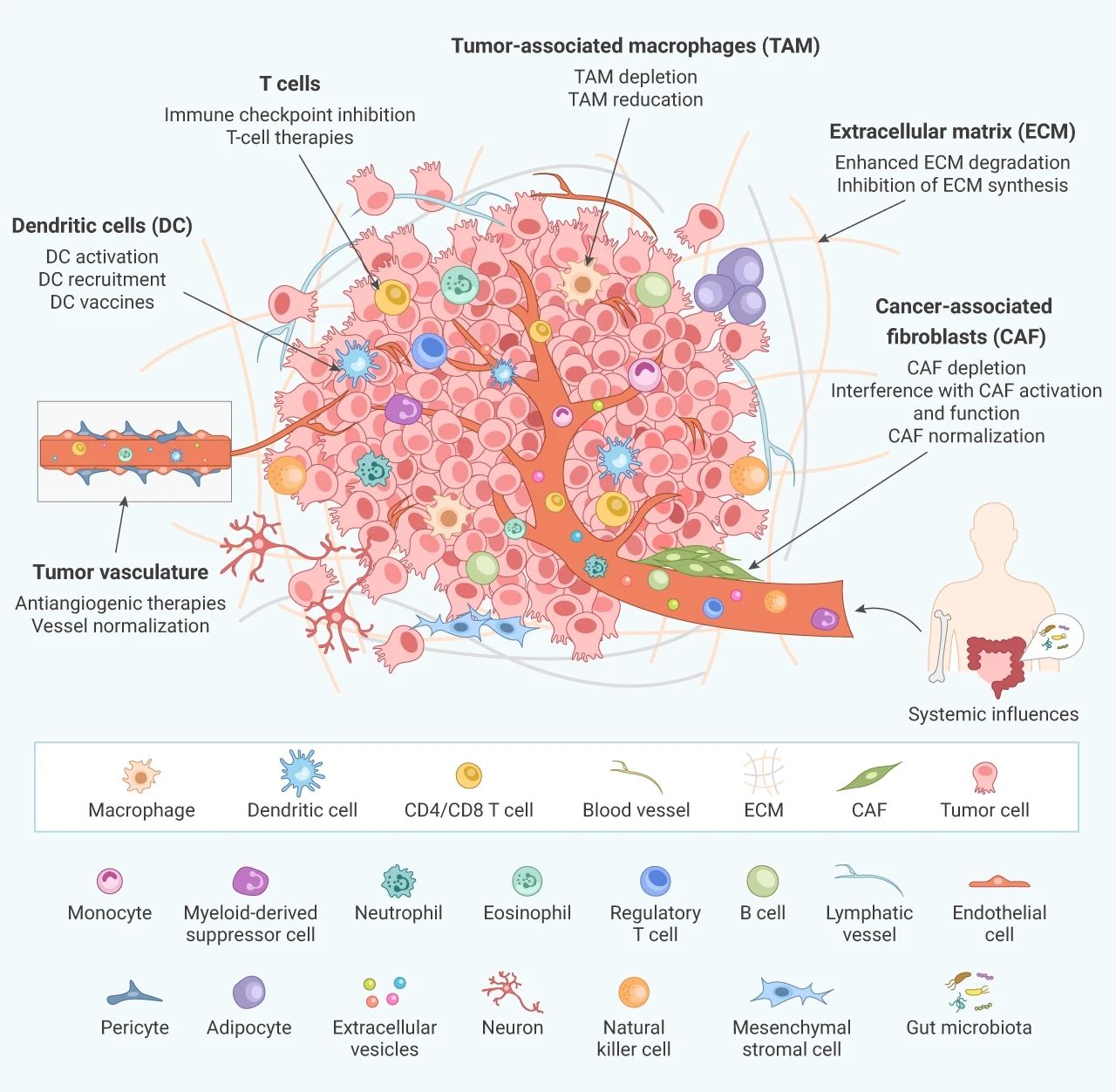
腫瘤細胞所在的細胞環境稱為腫瘤微環境 (下稱微環境),由一個復雜的網絡組成,包括多種類型的基質細胞 (成纖維細胞、淋巴細胞、巨噬細胞和內皮細胞)、免疫細胞 (T 和 B 淋巴細胞等) 和細胞外成分 (細胞因子、生長因子、激素、細胞外基質 ECM 等),它們圍繞著腫瘤細胞并由血管系統滋養。
腫瘤細胞和微環境之間的通訊機制很復雜,主體分為:1) 特定癌細胞與另一個細胞或細胞與 ECM 之間的依賴接觸性機制;2) 可溶性分子 (生長因子、趨化因子、細胞因子以及亞細胞結構,包括微囊泡和外泌體) 的非依賴接觸機制。這些相互作用通過近分泌和旁分泌機制、惡性細胞和非惡性基質細胞中的信號通路激活,在癌癥的進展過程中發揮重要作用,如誘導增殖和抑制細胞凋亡、誘導血管生成和避免缺氧、抑制免疫系統以及遠處轉移等。因此,靶向腫瘤微環境是一種預防轉移、克服獲得性耐藥和提高治療效果的具有廣闊前景的策略。
腫瘤的血管形成是一個復雜的過程,它受到惡性細胞和非惡性細胞通過自分泌和旁分泌信號通路產生的促血管生成因子和抗血管生成因子的嚴格調控。血管內皮生長因子 (VEGF/VEGF-A) 是參與內皮細胞 (EC) 激活的主要促血管生成因子,但許多其他生長因子也具有促血管生成作用,例如成纖維細胞生長因子 (FGF)、血小板衍生生長因子 (PDGF) 和表皮生長因子 (EGF)。此外,研究還表明,mTOR 通路和血管生成調節之間也有緊密聯系。
在免疫細胞的組成方面,腫瘤微環境在不同類型的癌癥中顯示出很大的多樣性。雖然一些腫瘤幾乎沒有炎癥信號,但其他腫瘤則顯示出大量的免疫細胞在外周或浸潤在腫瘤內。腫瘤細胞周圍環境的特點是炎癥介質的慢性過表達,免疫系統難以識別異常細胞并清除它們,即免疫細胞對腫瘤細胞無反應。考慮到免疫系統在腫瘤中的作用,可以通過 1) 抑制巨噬細胞募集和分化;2) 靶向慢性炎癥 (包括被激活的炎癥信號通路);3) 激活免疫系統的抗腫瘤活性應對腫瘤進展。
■ 抑制巨噬細胞募集和分化
腫瘤相關巨噬細胞 (TAM) 是微環境中最豐富的先天免疫細胞,為了響應微環境的變化,巨噬細胞可以極化為兩種類型:M1 和 M2。M1 型巨噬細胞釋放促炎細胞因子,如 TNF-α、IL-1 和 IL-12,增強 T 細胞功能,并參與抗腫瘤免疫,而 M2-型巨噬細胞釋放抗炎細胞因子,如 IL-10、TGF-β 和精氨酸酶,抑制 T 細胞功能,參與促腫瘤生長。相比之下,TAM 通常表現出 M2 樣表型。目前正在努力開發靶向 M2 細胞或將 M2 重新編程為 M1 細胞的治療方法。CSF-1 是巨噬細胞的主要調節因子,在腫瘤中的含量往往很高,是癌癥患者預后不良的指標。如 CSF-1R 激酶抑制劑 BLZ945 通過減少 M2 巨噬細胞極化阻止腫瘤進展并改善多形性膠質母細胞瘤 (GBM) 小鼠的存活率。
■ 靶向慢性炎癥 (包括一些腫瘤細胞和免疫細胞之間相互作用時被激活的炎癥信號通路)
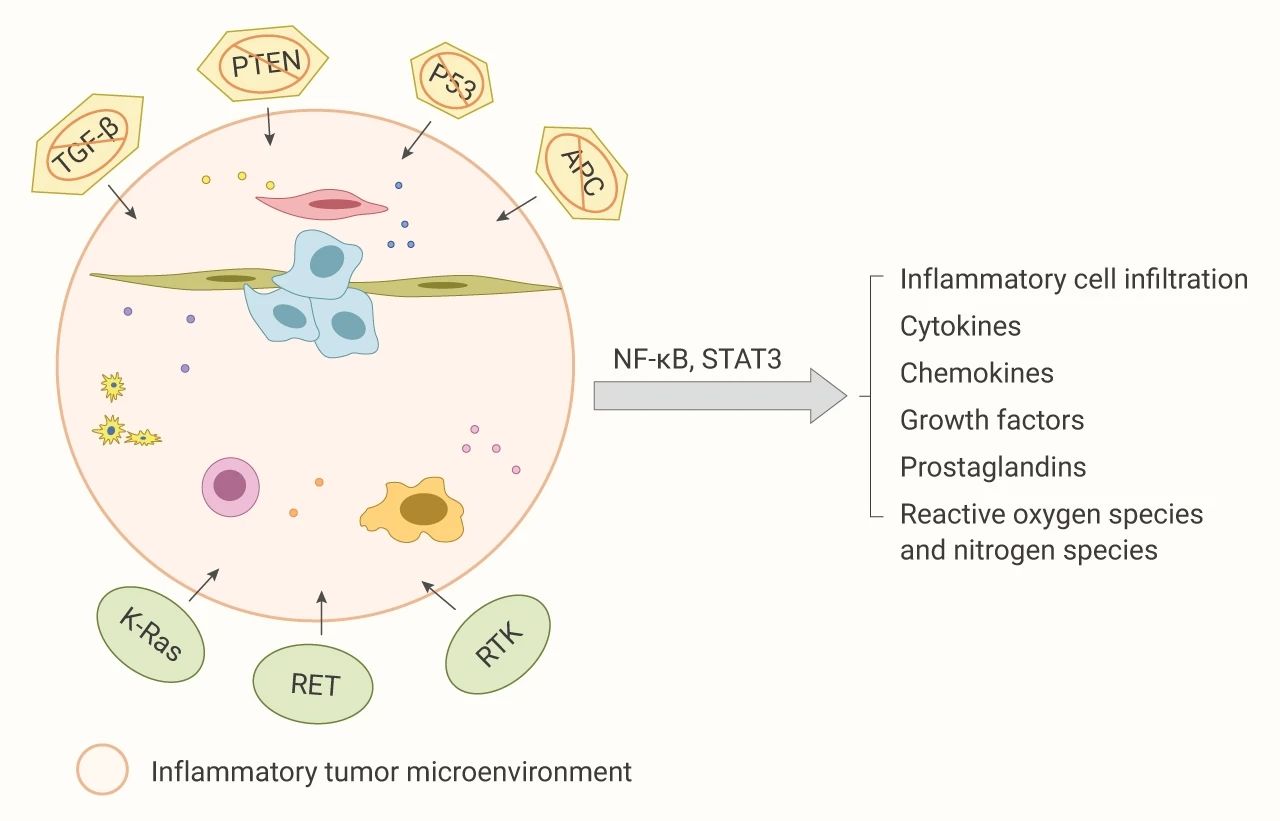
癌癥相關的慢性炎癥是癌組織的共同特征,其形成是一個復雜的過程,涉及環境因素與癌組織本身之間錯綜復雜的相互作用。癌組織中浸潤的炎癥細胞主要是慢性炎癥細胞,如巨噬細胞、淋巴細胞、髓源性抑制細胞 (MDSCs) 等。炎癥反應的最初目標是消除外來入侵者或受損組織。然而,炎性細胞的組成和功能通常在微環境中發生變化,會產生免疫抑制并有助于腫瘤免疫逃逸。如腫瘤細胞和基質細胞通過 NF-κB 和 STAT3 促進炎癥和免疫抑制,促使腫瘤細胞逃避免疫識別,參與腫瘤細胞增殖、轉移、耐藥和腫瘤血管生成。另外,與炎癥有關的 COX-2 以及趨化因子,例如 CXCR4,CCR5,CX3CR1 的異常也與腫瘤微環境有關。
■ 激活免疫系統的抗腫瘤活性
刺激免疫系統的抗腫瘤活性已被廣泛用于防止腫瘤進展,在免疫治療策略中,GM-CSF 因子的應用尤為突出。GM-CSF 可刺激巨噬細胞和樹突細胞上的抗原呈遞,進而刺激了抗癌抗體的抗體依賴性細胞毒性 (ADCC)。此外,靶向腫瘤細胞的免疫反應還在于靶向免疫檢查點抑制劑。免疫檢查點的靶向/抑制主要集中在細胞毒性 T 淋巴細胞相關蛋白 4 (CTLA-4) 以及程序性死亡 1 受體 (PD-1) 及其配體 PD-L1,如 Ipilimumab、Pembrolizumab。
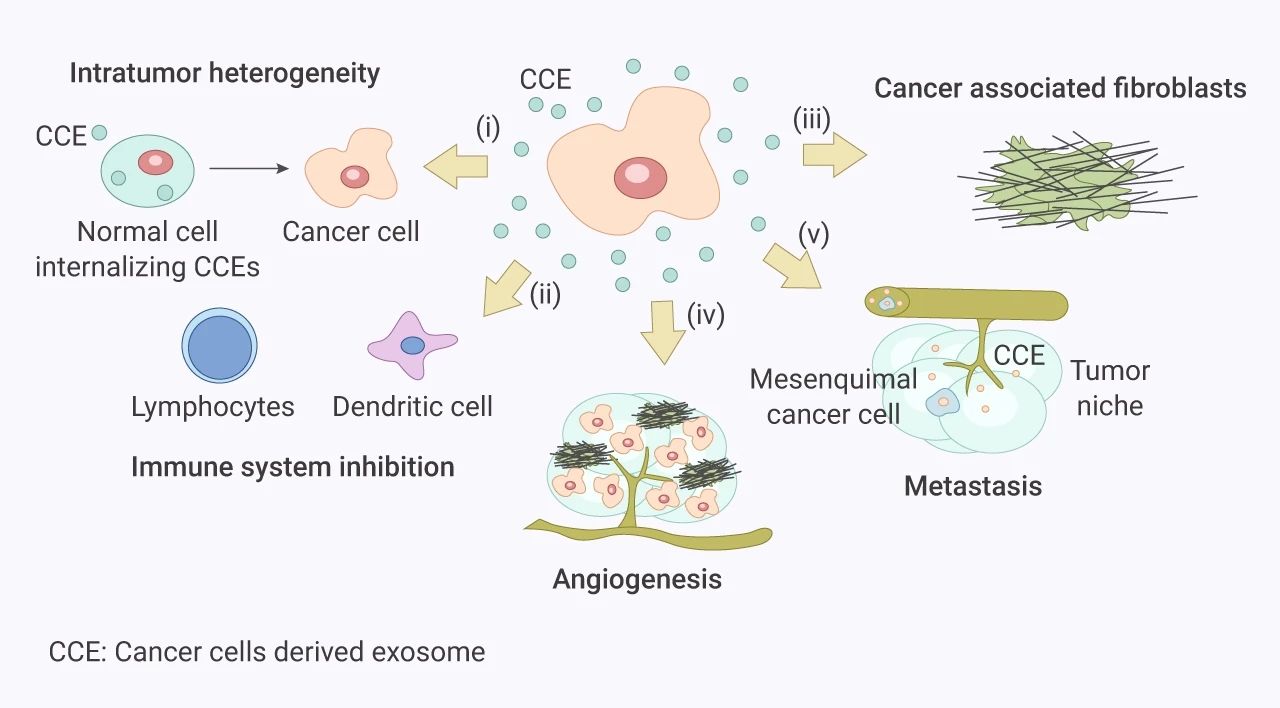
癌癥衍生的外泌體 (CCEs) 是腫瘤微環境形成的重要參與者,在癌癥和基質細胞之間的細胞間通訊中具有重要作用,這將導致腫瘤微環境的成熟和腫瘤的生長和增殖。
目前正在研究和開發許多方法來使癌癥治療的腫瘤微環境正常化。但毫無疑問的是,同時靶向癌細胞和基質細胞比單獨靶向癌細胞更有效,也更具有挑戰性。
MCE 的所有產品僅用作科學研究或藥證申報,我們不為任何個人用途提供產品和服務
參考文獻
1. Global Burden of Disease Cancer Collaboration, Fitzmaurice C, et al. Global, Regional, and National Cancer Incidence, Mortality, Years of Life Lost, Years Lived With Disability, and Disability-Adjusted Life-Years for 29 Cancer Groups, 1990 to 2016: A Systematic Analysis for the Global Burden of Disease Study. JAMA Oncol. 2018;4(11):1553-1568.
2. Pitt JM, Zitvogel L, et al. Targeting the tumor microenvironment: removing obstruction to anticancer immune responses and immunotherapy. Ann Oncol. 2016;27(8):1482-1492.
3. Martin M, et al. Targeting microenvironment in cancer therapeutics. Oncotarget. 2016;7(32):52575-52583.
4. Wu J, et al. Tumor microenvironment as the "regulator" and "target" for gene therapy. J Gene Med. 2019;21(7):e3088.
5. Chen F, Sun Y, et al. New horizons in tumor microenvironment biology: challenges and opportunities. BMC Med. 2015;13:45. Published 2015 Mar 5.
6. Wu T, Dai Y. Tumor microenvironment and therapeutic response. Cancer Lett. 2017;387:61-68.
7. Butturini E, Mariotto S. Tumor Dormancy and Interplay with Hypoxic Tumor Microenvironment. Int J Mol Sci. 2019;20(17):4305. Published 2019 Sep 3.
8. Casey SC, Felsher DW, et al. Cancer prevention and therapy through the modulation of the tumor microenvironment. Semin Cancer Biol. 2015;35 Suppl(Suppl):S199-S223.
9. Bejarano L, Jordāo MJC, Joyce JA. Therapeutic Targeting of the Tumor Microenvironment. Cancer Discov. 2021;11(4):933-959.
10. Roma-Rodrigues C, Baptista PV, Fernandes AR, et al. Targeting Tumor Microenvironment for Cancer Therapy. Int J Mol Sci. 2019;20(4):840. Published 2019 Feb 15.
11. Conciatori F, Ciuffreda L et al. Role of mTOR Signaling in Tumor Microenvironment: An Overview. Int J Mol Sci. 2018;19(8):2453. Published 2018 Aug 19.
12. Zhou K, et al. Targeting tumor-associated macrophages in the tumor microenvironment. Oncol Lett. 2020;20(5):234.
13. Achyut BR, Arbab AS. Myeloid cell signatures in tumor microenvironment predicts therapeutic response in cancer. Onco Targets Ther. 2016;9:1047-1055. Published 2016 Mar 1.
14. Hsieh CH, et al. Snail-overexpressing Cancer Cells Promote M2-Like Polarization of Tumor-Associated Macrophages by Delivering MiR-21-Abundant Exosomes. Neoplasia. 2018;20(8):775-788.
15. Fang H, Declerck YA. Targeting the tumor microenvironment: from understanding pathways to effective clinical trials. Cancer Res. 2013;73(16):4965-4977. 1
16. Yang L, Lin PC. Mechanisms that drive inflammatory tumor microenvironment, tumor heterogeneity, and metastatic progression. Semin Cancer Biol. 2017;47:185-195.
17. Roma-Rodrigues C, et al. Exosome in tumour microenvironment: overview of the crosstalk between normal and cancer cells. Biomed Res Int. 2014;2014:179486.
18. Anari F, Zibelman M, et al. Impact of tumor microenvironment composition on therapeutic responses and clinical outcomes in cancer. Future Oncol. 2018;14(14):1409-1421
腫瘤微環境
腫瘤細胞所在的細胞環境稱為腫瘤微環境 (下稱微環境),由一個復雜的網絡組成,包括多種類型的基質細胞 (成纖維細胞、淋巴細胞、巨噬細胞和內皮細胞)、免疫細胞 (T 和 B 淋巴細胞等) 和細胞外成分 (細胞因子、生長因子、激素、細胞外基質 ECM 等),它們圍繞著腫瘤細胞并由血管系統滋養。
腫瘤細胞和微環境之間的通訊機制很復雜,主體分為:1) 特定癌細胞與另一個細胞或細胞與 ECM 之間的依賴接觸性機制;2) 可溶性分子 (生長因子、趨化因子、細胞因子以及亞細胞結構,包括微囊泡和外泌體) 的非依賴接觸機制。這些相互作用通過近分泌和旁分泌機制、惡性細胞和非惡性基質細胞中的信號通路激活,在癌癥的進展過程中發揮重要作用,如誘導增殖和抑制細胞凋亡、誘導血管生成和避免缺氧、抑制免疫系統以及遠處轉移等。因此,靶向腫瘤微環境是一種預防轉移、克服獲得性耐藥和提高治療效果的具有廣闊前景的策略。

圖 1. 腫瘤微環境的主要成分
靶向腫瘤血管生成
腫瘤的血管形成是一個復雜的過程,它受到惡性細胞和非惡性細胞通過自分泌和旁分泌信號通路產生的促血管生成因子和抗血管生成因子的嚴格調控。血管內皮生長因子 (VEGF/VEGF-A) 是參與內皮細胞 (EC) 激活的主要促血管生成因子,但許多其他生長因子也具有促血管生成作用,例如成纖維細胞生長因子 (FGF)、血小板衍生生長因子 (PDGF) 和表皮生長因子 (EGF)。此外,研究還表明,mTOR 通路和血管生成調節之間也有緊密聯系。
靶向免疫系統
在免疫細胞的組成方面,腫瘤微環境在不同類型的癌癥中顯示出很大的多樣性。雖然一些腫瘤幾乎沒有炎癥信號,但其他腫瘤則顯示出大量的免疫細胞在外周或浸潤在腫瘤內。腫瘤細胞周圍環境的特點是炎癥介質的慢性過表達,免疫系統難以識別異常細胞并清除它們,即免疫細胞對腫瘤細胞無反應。考慮到免疫系統在腫瘤中的作用,可以通過 1) 抑制巨噬細胞募集和分化;2) 靶向慢性炎癥 (包括被激活的炎癥信號通路);3) 激活免疫系統的抗腫瘤活性應對腫瘤進展。
■ 抑制巨噬細胞募集和分化
腫瘤相關巨噬細胞 (TAM) 是微環境中最豐富的先天免疫細胞,為了響應微環境的變化,巨噬細胞可以極化為兩種類型:M1 和 M2。M1 型巨噬細胞釋放促炎細胞因子,如 TNF-α、IL-1 和 IL-12,增強 T 細胞功能,并參與抗腫瘤免疫,而 M2-型巨噬細胞釋放抗炎細胞因子,如 IL-10、TGF-β 和精氨酸酶,抑制 T 細胞功能,參與促腫瘤生長。相比之下,TAM 通常表現出 M2 樣表型。目前正在努力開發靶向 M2 細胞或將 M2 重新編程為 M1 細胞的治療方法。CSF-1 是巨噬細胞的主要調節因子,在腫瘤中的含量往往很高,是癌癥患者預后不良的指標。如 CSF-1R 激酶抑制劑 BLZ945 通過減少 M2 巨噬細胞極化阻止腫瘤進展并改善多形性膠質母細胞瘤 (GBM) 小鼠的存活率。
■ 靶向慢性炎癥 (包括一些腫瘤細胞和免疫細胞之間相互作用時被激活的炎癥信號通路)
癌癥相關的慢性炎癥是癌組織的共同特征,其形成是一個復雜的過程,涉及環境因素與癌組織本身之間錯綜復雜的相互作用。癌組織中浸潤的炎癥細胞主要是慢性炎癥細胞,如巨噬細胞、淋巴細胞、髓源性抑制細胞 (MDSCs) 等。炎癥反應的最初目標是消除外來入侵者或受損組織。然而,炎性細胞的組成和功能通常在微環境中發生變化,會產生免疫抑制并有助于腫瘤免疫逃逸。如腫瘤細胞和基質細胞通過 NF-κB 和 STAT3 促進炎癥和免疫抑制,促使腫瘤細胞逃避免疫識別,參與腫瘤細胞增殖、轉移、耐藥和腫瘤血管生成。另外,與炎癥有關的 COX-2 以及趨化因子,例如 CXCR4,CCR5,CX3CR1 的異常也與腫瘤微環境有關。

圖 2. 腫瘤抑制因子丟失或致癌基因的激活誘導的炎癥微環境
■ 激活免疫系統的抗腫瘤活性
刺激免疫系統的抗腫瘤活性已被廣泛用于防止腫瘤進展,在免疫治療策略中,GM-CSF 因子的應用尤為突出。GM-CSF 可刺激巨噬細胞和樹突細胞上的抗原呈遞,進而刺激了抗癌抗體的抗體依賴性細胞毒性 (ADCC)。此外,靶向腫瘤細胞的免疫反應還在于靶向免疫檢查點抑制劑。免疫檢查點的靶向/抑制主要集中在細胞毒性 T 淋巴細胞相關蛋白 4 (CTLA-4) 以及程序性死亡 1 受體 (PD-1) 及其配體 PD-L1,如 Ipilimumab、Pembrolizumab。
靶向外泌體
癌癥衍生的外泌體 (CCEs) 是腫瘤微環境形成的重要參與者,在癌癥和基質細胞之間的細胞間通訊中具有重要作用,這將導致腫瘤微環境的成熟和腫瘤的生長和增殖。

圖 3. 癌癥衍生的外泌體介導的腫瘤微環境過程
總結:癌癥的發展是一個復雜的生物學過程。從各類實驗可以發現癌細胞在大多數情況下,其生長依賴于局部微環境。腫瘤微環境是由癌細胞和基質細胞逐漸啟動和建立的。癌細胞和基質細胞之間的相互作用通過細胞間接觸或微環境中的可溶性小分子促進癌癥進展。在這個過程中,癌細胞通過這些相互作用改變了基質細胞的一些特性。反過來,改變的基質細胞以類似的方式影響癌細胞的行為。而所有涉及的基質細胞以及細胞因子都可能作為微環境正常化的靶點。另外,還可靶向腫瘤微環境代謝相關的靶點 HIF-1α、ROS、IDO 酶等。目前正在研究和開發許多方法來使癌癥治療的腫瘤微環境正常化。但毫無疑問的是,同時靶向癌細胞和基質細胞比單獨靶向癌細胞更有效,也更具有挑戰性。
| 相關產品 |
| Cediranib 高選擇性,有口服活性的 VEGFR2 抑制劑,對 Flt1, KDR, Flt4, PDGFRα, PDGFRβ, c-Kit 的 IC50 值分別為 <1 nM, <3 nM, 5 nM, 5 nM, 36 nM, 2 nM。 |
| Brivanib alaninate ATP 競爭性的 VEGFR2 抑制劑,IC50 值為 25 nM。可以適度抑制 VEGFR1 和 FGFR1。 |
| Rapamycin 特異性的 mTOR 抑制劑,作用于 HEK293 細胞,抑制 mTOR,IC50 為 0.1 nM。Rapamycin 與 FKBP12 結合且抑制 mTORC1。Rapamycin 還是一種自噬 (autophagy) 激活劑,免疫抑制劑。 |
| CSF-1R 一種有效,選擇性和可透過血腦屏障的 CSF-1R (c-Fms) 抑制劑,IC50 為 1 nM,選擇性是其他受體酪氨酸激酶同系物的 1000 倍。 |
| Zerumbone 通過對不同途徑調控,如 NF-κB、Akt、IL-6/JAK2/STAT3 及其下游靶蛋白,顯著抑制腫瘤的增殖、存活、血管生成、侵襲和轉移,顯示出其抗癌作用。 |
| C188-9 特異性 STAT3 抑制劑,抑制 G-CSF 誘導的 STAT3 磷酸化,誘導 AML 細胞系和原代標本的凋亡,并在低微摩爾范圍內抑制 AML 細胞集落形成。 |
| Celecoxib 選擇性的 COX-2 抑制劑,IC50 為 40 nM。 |
| Plerixafor 選擇性的 CXCR4 拮抗劑,IC50 為 44 nM。防止 腫瘤相關巨噬細胞 (TAM) 浸潤到腫瘤組織中。 |
| Maraviroc 選擇性的 CCR5 拮抗劑,具有抑制 HIV 的活性。顯著降低腫瘤相關巨噬細胞 (TAM) 浸潤和腫瘤生長。 |
| Ganetespib HSP90 抑制劑,通過抑制 HIF-1α 和 STAT3 對結直腸癌具有抗血管生成作用。 |
參考文獻
1. Global Burden of Disease Cancer Collaboration, Fitzmaurice C, et al. Global, Regional, and National Cancer Incidence, Mortality, Years of Life Lost, Years Lived With Disability, and Disability-Adjusted Life-Years for 29 Cancer Groups, 1990 to 2016: A Systematic Analysis for the Global Burden of Disease Study. JAMA Oncol. 2018;4(11):1553-1568.
2. Pitt JM, Zitvogel L, et al. Targeting the tumor microenvironment: removing obstruction to anticancer immune responses and immunotherapy. Ann Oncol. 2016;27(8):1482-1492.
3. Martin M, et al. Targeting microenvironment in cancer therapeutics. Oncotarget. 2016;7(32):52575-52583.
4. Wu J, et al. Tumor microenvironment as the "regulator" and "target" for gene therapy. J Gene Med. 2019;21(7):e3088.
5. Chen F, Sun Y, et al. New horizons in tumor microenvironment biology: challenges and opportunities. BMC Med. 2015;13:45. Published 2015 Mar 5.
6. Wu T, Dai Y. Tumor microenvironment and therapeutic response. Cancer Lett. 2017;387:61-68.
7. Butturini E, Mariotto S. Tumor Dormancy and Interplay with Hypoxic Tumor Microenvironment. Int J Mol Sci. 2019;20(17):4305. Published 2019 Sep 3.
8. Casey SC, Felsher DW, et al. Cancer prevention and therapy through the modulation of the tumor microenvironment. Semin Cancer Biol. 2015;35 Suppl(Suppl):S199-S223.
9. Bejarano L, Jordāo MJC, Joyce JA. Therapeutic Targeting of the Tumor Microenvironment. Cancer Discov. 2021;11(4):933-959.
10. Roma-Rodrigues C, Baptista PV, Fernandes AR, et al. Targeting Tumor Microenvironment for Cancer Therapy. Int J Mol Sci. 2019;20(4):840. Published 2019 Feb 15.
11. Conciatori F, Ciuffreda L et al. Role of mTOR Signaling in Tumor Microenvironment: An Overview. Int J Mol Sci. 2018;19(8):2453. Published 2018 Aug 19.
12. Zhou K, et al. Targeting tumor-associated macrophages in the tumor microenvironment. Oncol Lett. 2020;20(5):234.
13. Achyut BR, Arbab AS. Myeloid cell signatures in tumor microenvironment predicts therapeutic response in cancer. Onco Targets Ther. 2016;9:1047-1055. Published 2016 Mar 1.
14. Hsieh CH, et al. Snail-overexpressing Cancer Cells Promote M2-Like Polarization of Tumor-Associated Macrophages by Delivering MiR-21-Abundant Exosomes. Neoplasia. 2018;20(8):775-788.
15. Fang H, Declerck YA. Targeting the tumor microenvironment: from understanding pathways to effective clinical trials. Cancer Res. 2013;73(16):4965-4977. 1
16. Yang L, Lin PC. Mechanisms that drive inflammatory tumor microenvironment, tumor heterogeneity, and metastatic progression. Semin Cancer Biol. 2017;47:185-195.
17. Roma-Rodrigues C, et al. Exosome in tumour microenvironment: overview of the crosstalk between normal and cancer cells. Biomed Res Int. 2014;2014:179486.
18. Anari F, Zibelman M, et al. Impact of tumor microenvironment composition on therapeutic responses and clinical outcomes in cancer. Future Oncol. 2018;14(14):1409-1421
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





