icIEF毛細管電泳技術在生物制藥、疫苗和基因治療的應用

2018年CE Pharm年度大獎授予成像毛細管電泳技術(icIEF)發明人Dr. Jiaqi Wu,以獎勵其對毛細管電泳技術在生物制藥領域應用做出的貢獻。
2022年吳博士最新撰文,系統回顧了icIEF技術及在生物制藥、疫苗和病毒表征方面應用進展,再次說明了icIEF技術已成為生物制藥行業的主流技術,同時為未來技術發展指明了方向。

本文將幫助生物制藥、疫苗和基因治療領域科研人員更好地理解毛細管電泳技術,更好地運用此技術加速生物藥物研發。
傳統毛細管等電聚焦電泳(cIEF)技術局限
1985年,Hjertén和Zhu在毛細管電泳(CE)儀上首次實現cIEF。與平板膠IEF相比,clEF具有自動化程度高和可定量等優點。然而,經過15年后,作為蛋白質藥物電荷異質性表征方法,cIEF并沒有被制藥行業領域廣泛接受。
主要原因是通用的商業化CE儀器只配備了單點紫外吸收和熒光檢測器,使運行clEF方法很有挑戰性。IEF分離過程后,依靠化學和壓力方式移動毛細管內聚焦的蛋白條帶,使其經過單點檢測器,這個遷移方式可能會產生問題,如峰形扭曲、模糊或分辨率不佳,需要增加運行時間,并且方法優化具有挑戰性。而且,分離柱內部發生聚焦和遷移步驟無法被觀察到,不易優化。
cIEF重現性差是樣品聚集/沉淀和等電聚焦過程中時間過長而產生的變化造成的。單點檢測cIEF在整個遷移過程中都要施加分離電壓,以防止分離柱內集中的樣品條帶擴散,這意味著分離的條帶仍然是焦點,聚焦過程不能在最佳時間停止,對樣本進行過度聚焦。典型實驗遷移時間需要20分鐘到40分鐘不等(視樣本而定),較長的聚焦和遷移時間增加了樣品聚集/沉淀和樣品變化的可能性。
下圖使用icIEF聚焦時間誘導聚集例子來說明這一難題,當聚焦時間超過10min時,蛋白質聚集導致電泳圖開始出現尖峰。因此,當聚焦時間超過10分鐘時,峰型不穩定,導致數據重復性較差。
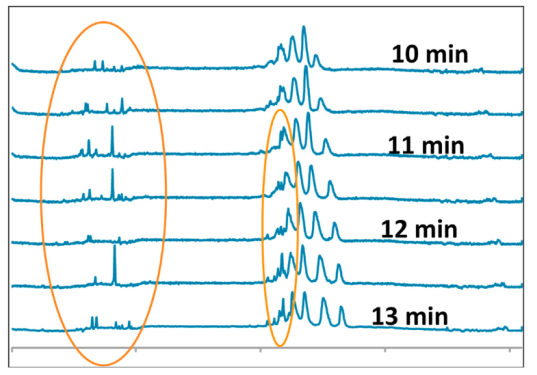
單克隆抗體(mAb)在直徑100 μm、長5 cm毛細管內等電聚焦過程
全柱成像毛細管等電聚焦電泳技術(icIEF)優勢
clEF聚焦過程結束時,所有樣品條帶都聚焦在毛細管分離柱內,并且幾乎是靜止的。因此,采用全柱成像是cIEF理想的檢測方法。
1992年和1994年Wu和Pawliszyn首次提出了基于反射指數和紫外吸收的全柱成像檢測技術,并于1998年首次商業化全柱成像紫外吸收cIEF,稱為icIEF。
icIEF具有方法開發簡單、通量高、等電點(pI)測定和定量重現性好、易于開發平臺方法等優點。去除了傳統clEF遷移步驟,將分析時間從40到60分鐘減少到每個樣品5到15分鐘。icIEF方法每次進樣分析時間短,并能夠實時觀察整個聚焦過程,很容易地識別出峰型不重現的原因,如蛋白質聚集情況下,可以通過優化聚焦時間或添加穩定劑來避免。
icIEF技術成功商業化后,已經逐漸取代傳統的cIEF技術,在生物制藥行業得到了廣泛應用。
生物制藥和疫苗中icIEF技術應用
1
制劑配方和穩定性研究
蛋白質治療藥物需要詳細制劑研究來確保產品穩定性。在產品開發早期階段,需要評估和表征產品在各種強制條件如溫度和pH下穩定性。
多項研究表明包括單克隆抗體和糖蛋白、抗體偶聯藥物和疫苗,iclEF結果可作為多種蛋白質治療藥物的穩定性指標。制劑研究的樣本量比較大,對通量要求高。與傳統cIEF、平板凝膠IEF和大多數離子交換色譜法相比,icIEF具有顯著的高通量優勢。
早期制劑階段具有許多候選樣本,對每個候選樣本進行單個方法優化將使很難實現,最好采用廣泛適用的平臺化方法。
2009年報道了第一個平臺iclEF方法表征了25個單克隆抗體,結果表明iclEF方法適用于單克隆抗體鑒定和純度測定,目前icIEF方法已被廣泛用于制藥行業制劑和穩定性研究。
2
質量控制(QC)
根據生物制藥ICH指南,必須在整個生產、運輸和存儲過程中監測電荷異質性。iclEF是檢測蛋白質電荷異質性的標準工具。
2002年icIEF首先報道用于單克隆抗體藥物的質量控制,之后,多個多中心聯合驗證項目對單克隆抗體藥物icIEF 質控方法進行了評估和驗證。
第一項是11家國際制藥公司12個實驗室聯合研究,結果強調了iclEF對治療性抗體電荷異質性作為穩定性指標的重要性,并首次提出iclEF方法可替代傳統的cIEF方法。
第二項是中國8家公司10個實驗室對iclEF方法進行了單克隆抗體藥物檢測方法的聯合驗證,結果表明了方法可靠性和科學性,并可定量檢測單克隆抗體中含量2.3%的微小組分。
最近,重組人紅細胞生成素(rhEPO)的電荷異質性質控方法已被驗證,6家制藥公司6個實驗室驗證了icIEF用于rhEPO分析可靠性。
這些研究證明了iclEF方法能根據ICH指南準確并穩定地表征蛋白藥物(mAb或rhEPO)的電荷異質性,并概述了使用iclEF方法進行質量控制的預期結果。
3
蛋白糖基化
蛋白質藥物制劑中糖基化可能會對產品質量產生負面影響,如糖基化發生在單克隆抗體結合位點,可能影響其安全性和有效性。iclEF方法是單克隆抗體糖基化結合位點研究工具之一。
如果不注意控制糖的濃度,會產生過量糖基化產物。糖基化很難通過離子交換色譜法來觀察,因為糖基化可通過與色譜固定相的相互作用發生可逆反應。iclEF方法已被證明可以觀察到使用離子交換色譜無法檢測到的糖基化電荷異質性。可清楚地觀察到糖基化構型與非糖基化構型酸性pl的微小偏移(pH單位0.05)。
一項研究輸液介質中高濃度葡萄糖對單抗糖基化影響。葡萄糖粘度使IEX分析起來很困難。由于葡萄糖不帶電荷,電泳時不遷移,因此在整個IEF分離過程中,分離柱可以填充不同濃度葡萄糖,用于研究葡萄糖對單抗糖基化的影響。
另一項研究中是使用iclEF方法監測單抗的體內外穩定性,分析在PBS和血漿中孵育后的不同單克隆抗體,以及體內循環中產生的單克隆抗體。在血漿培養和體內循環中,發現酸性變異體的相對百分比顯著增加,可能與糖基化增加有關。
生物仿制藥開發人員需通過與生物藥參考品進行綜合對比性研究來證明相似度,包括兩種藥物的降解路徑。icIEF方法是一種很好的對比性研究工具,可反映蛋白質微小變化。如用來比較創新的融合蛋白及其生物類似物之間的唾液酸化程度,以及創新的單克隆抗體及其生物類似物之間的唾液酸化程度及降解速度。
4
工藝優化研究
不同細胞系的高糖基化蛋白藥物可能具有不同的糖基化特征。高通量iclEF已用于產品工藝開發早期來篩選細胞系。
一項研究是篩選從不同CHO細胞系獲得的白細胞介素受體的糖基化譜,結果顯示iclEF對唾液酸含量的分辨率比陰離子交換色譜高得多。同樣地,許多抗體偶聯藥物(ADC)被設計成將未配對的半胱氨酸置于單抗的重鏈上,以便隨后與藥物偶聯。這些半胱氨酸增加了單抗的電荷異質性,通過icIEF可以觀察到它們對pl的影響。相對于離子交換色譜法,icIEF法對于ADC和其他復雜分子通常具有較高的分辨率。
5
不同蛋白質藥物的電荷異質性表征
單克隆抗體
單抗是最重要的蛋白質治療藥物類別,FDA批準了70多種基于單抗的治療藥物。原理上,iclEF技術與離子交換色譜技術是一種正交技術。然而,iclEF技術主要優勢是其平臺化檢測能力。對于不同的單抗,iclEF方法只需要小的修改就可應用到新的單抗上。相比之下,對于離子交換色譜技術,不同單抗可能需要優化不同的方法參數。icIEF被用于制藥行業一些基本研究領域,如單抗重鏈和輕鏈電荷異質性,生物仿制藥特定的電荷異質性,單抗結合抗原和血清白蛋白等。
抗體偶聯藥物 (ADC)
與單克隆抗體一樣,制劑研究中iclEF方法可表征ADC,用于藥物偶聯水平監測和最終產品質量控制如曲妥珠單抗偶聯藥物。與離子交換色譜和疏水色譜相比,iclEF用于ADC分析的一個優點是更高分辨率。色譜方法可能是由于色譜柱固定相和ADC之間的非特異性相互作用,由于ADC疏水性導致。當用離子交換色譜法表征ADC及其裸單抗的電荷分布時,可很好地分離了單克隆抗體的電荷變異體,但ADC分辨率較差。當使用iclEF方法時,單抗和ADC電荷分布和分離分辨率相同。這導致許多實驗室首選iclEF方法表征ADC電荷異質性。
雙特異性抗體 (BsMAB)
BsMABs通常具有更多的電荷異質性,可使用iclEF進行檢測。采用iclEF方法研究了BsMAB的脫酰胺和異構化,也可檢測雙抗與其靶點之一血清白蛋白的結合能力。
重組融合蛋白
融合蛋白藥物通常比其他類型的藥物有更多異質性。離子交換色譜在異構體定量方面具有良好的精度,但對融合蛋白異構體可能沒有足夠的分辨率。與ADC和BsMABs的情況一樣,icIEF也是這些更復雜的融合蛋白電荷表征的強大工具。早在2001年被首次用于融合蛋白藥物Enbrel的電荷表征。此外,使用icIEF比較了融合蛋白創新藥和生物仿制藥的糖基化特征。最近,一種重組融合蛋白藥物的平臺iclEF方法被開發出來,并應用于9種商業化融合蛋白。
疫苗和病毒
疫苗是一類復雜制劑,可根據其核心成分劃分為不同類別。一些疫苗利用多糖結合到蛋白質載體,提供保護免受細菌感染。白喉類毒素和一種無毒白喉毒素變種CRM197是常用的蛋白質載體。Rustandi等利用iclEF方法表征CRM197蛋白載體。另一項研究也表明,iclEF方法有助于蓖麻毒素疫苗的制劑優化。
近年來,mRNA脂質納米顆粒(LNPs)已被采用為一種有效的疫苗遞送劑,與傳統的疫苗遞送方法相比具有一些優勢。色譜法難以對表面電荷進行表征時,iclEF方法已成功開發出用于表征mRNA脂質納米顆粒的表面電荷,作為不同帶電脂質體的特征分析,并評估mRNA疫苗的定量穩定性。
病毒樣顆粒(VLPs)是強有力的疫苗遞送方式,與其他蛋白質藥物一樣,這些疫苗也需要電荷表征。VLPs通常是非常大的分子,因此很難用沒有固定相的色譜方法來表征電荷異質性,icIEF已被證明是VLPs電荷表征和pl測量的強大工具。2004年,第一次使用icIEF方法測定了VLP pl值, icIEF已用于乙型肝炎VLP疫苗的電荷表征。此外,變性諾瓦克病毒VLP疫苗的iclEF電泳圖譜可作為不同類型、不同批次VLP的指紋圖譜,甚至可潛在地識別大量失效的VLP產品。
一些由活病毒或滅活病毒組成的疫苗,iclEF方法已用于確定真實病毒的pl值,如活脊髓灰質炎病毒和人乳頭瘤病毒。沒有其他方法報道過這兩種病毒的pl測定。在這些研究中,病毒的pl信息分別對優化滅活過程和開發病毒疫苗具有重要意義。
icIEF技術新進展及應用
01
自發熒光檢測
icIEF已被制藥行業廣泛接受,但因為紫外280nm光吸收檢測靈敏度較低,限制了在產品開發后期應用潛力。2016年ProteinSimple推出了一種商業化儀器Maurice,利用紫外誘導檢測蛋白質自發熒光,具有更高的靈敏度。
優勢是不需要用熒光染料標記樣品。天然熒光檢測靈敏度的提高可能使最終制劑中的激素藥物和疫苗的電荷表征成為可能。與單抗藥物不同,這些類型的治療藥物效力高,在最終產品制劑中的濃度要低得多,這使得很難對最終藥物產品進行電荷表征。最近,一個研究小組證明了自發熒光對重組人紅細胞生成素(rhEPO)最終產物的電荷表征非常重要,這些產物含有高濃度的人血清白蛋白。熒光模式的定量限(LOQ)約為紫外吸收模式的1/50。
為了進一步提高熒光的靈敏度,可以考慮使用激發器作為激發光。實現這一目標的一種方法是將激發光引入毛細管的一端,同時使用全柱成像系統收集發射熒光。
2
免疫檢測法聯用iclEF
化學發光是最靈敏的檢測方式之一。icIEF結合化學發光全柱成像技術已經上市,使用抗體雜交已經聚焦分離的蛋白質。與熒光檢測不同,化學發射光的信號背景非常低,使其成為一種高靈敏度的檢測形式。除了高靈敏度之外,抗體免疫檢測具有很高的特異性。
3
iclEF與質譜聯用
質譜被認為是氨基酸及蛋白質鑒定的金標準。如IEF與MS檢測器結合,就可實現pI和大小二維分離。此外,clEF可分離不同修飾的蛋白質構型,可用質譜進行鑒定。
雖然cIEF- MS的研究開始于20世紀80年代末,但如前所述,傳統的cIEF采用柱上單點檢測器,存在局限性。iclEF與MS聯用開始于大約10年前,主要優點是在將分離的蛋白條帶引入MS之前,可很容易地優化IEF分離,直接將分離的蛋白條帶從iclEF柱推入MS檢測器。該設計中,分離通道與MS接口之間的距離可能會降低分離的分辨率。一種基于微芯片的iclEF與MS結合并商業化,解決了這一問題。微芯片既是分離通道又是電離噴霧器,幾乎消除了分離通道與MS界面之間的距離。
總結
經過近30年的發展,在制藥行業中產品開發、質量控制和放行過程,icIEF已成為蛋白質電荷表征的首選方法。
更高靈敏度的檢測模式如熒光和化學發光,將擴大iclEF在制藥工業和生物研究中上游領域的應用,將在蛋白質藥物研究、疫苗開發和基因治療領域有更大的應用空間。
隨著icIEF與質譜聯用技術的發展,有望取代液相色譜-質譜聯用技術在制藥行業的某些應用。這些創新開啟了iclEF令人興奮的下一個篇章,必將在藥物工業領域發揮更大的作用。
掃描下方二維碼獲取資料






