利用Labelfree蛋白組學技術解析抗精神病藥物的心臟毒性機制

長期使用抗精神病藥物是導致心肌損傷甚至心臟性猝死的常見原因,常常導致停藥或治療不連續。但是抗精神病藥物對心臟產生毒性的機制很大程度上仍然是未知的。
2022年6月,復旦大學遺傳工程國家重點實驗室金力院士與復旦大學附屬中山醫院鄒云增教授及復旦大學基礎醫學院李立亮副教授團隊合作,在Nature旗下Signal Transduction and Targeted Therapy(IF 38.104)雜志上發表了題為“CB1R-stabilized NLRP3 inflammasome drives antipsychotics cardiotoxicity”的研究論文,該文章利用Labelfree蛋白組學、RNA測序等方法發現NLRP3 炎癥小體介導的細胞焦亡主要與多種抗精神病藥物的心臟毒性有關,且發現CB1R 是NLRP3 炎性體的上游調節劑。此外,篩選到了安全、低毒的CB1R拮抗劑作為藥物毒性的聯合治療策略。中科新生命為該研究提供了Labelfree蛋白組學技術服務。
研究材料:小鼠心肌細胞、基因敲除小鼠、人心臟組織
技術路線:
1. 抗精神病藥 (AP) 早期可引起心臟毒性
2. 多種AP藥物激活NLRP3炎癥小體,誘導心肌細胞焦亡
3. NLRP3炎癥小體介導的焦亡與AP藥物的心臟毒性密切相關
4. CB1R是AP藥物的直接靶點,對NLRP3炎性小體起重要調控作用
5. CB1R通過177-209氨基酸殘基與NLRP3炎癥小體相互作用并阻止其降解
6. Cb1r基因敲除改善AP藥物誘導的焦亡和心臟毒性
7. CB1R抑制劑保護小鼠免受AP藥物的心臟毒性而不引起額外的副作用
8. 在人心臟標本中,CB1R的表達與AP藥物誘導的焦亡和纖維化程度呈正相關
研究結果
1. 表型分析:抗精神病藥 (AP) 早期可引起心臟毒性
研究人員首先使用抗精神病藥奧氮平(Olz)_對小鼠進行日常治療,然后進行多器官毒性評估,結果發現隨著抗精神病藥給藥時間延長,AP藥物在心臟中出現了明顯的蓄積,且AP藥物引起的心臟毒性比糖脂代謝紊亂或其他功能障礙的發生更早出現。

圖1 抗精神病藥對心臟的毒性作用
2.機制分析(轉錄組學):多種AP藥物激活NLRP3炎癥小體,誘導心肌細胞焦亡
接下來研究人員對Olz處理后的心臟進行RNA測序,結果發現GO富集分析中程序性細胞死亡途徑,特別是炎癥體介導的細胞焦亡顯著富集。WB等實驗發現NLRP3炎性小體(由ASC、Caspase-1和NLRP3組成的復合體)和促炎因子(IL-1β、IL-18等)的蛋白水平以Olz劑量和時間依賴性的方式顯著增強。其他兩種AP藥物氯氮平(Clz) 和喹硫平(Que)與Olz發揮了相同的作用,也會導致促炎因子的的分泌和焦亡蛋白的表達。此外通過敲除焦亡基因或加入NLRP3炎癥小體抑制劑等方式,研究人員確定NLRP3炎性小體參與AP藥物誘導的焦亡且焦亡在AP藥物細胞毒性中的特異性。
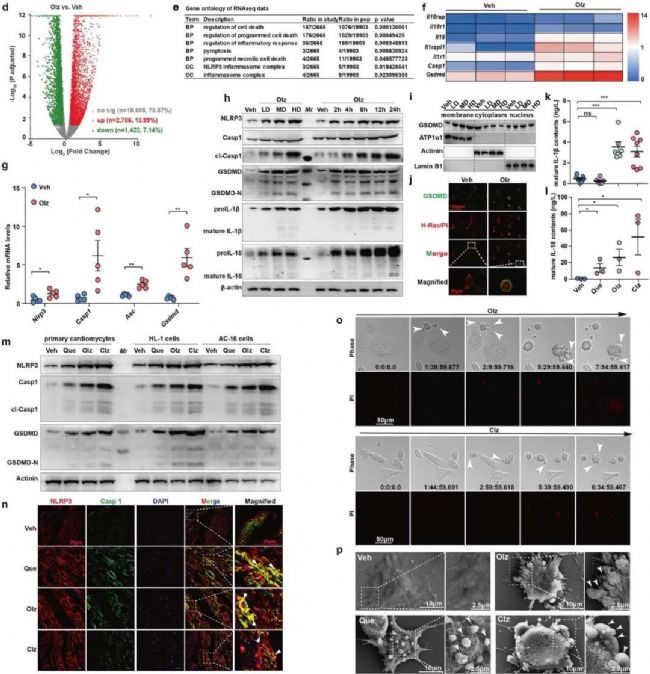
圖2 AP藥物激活NLRP3炎癥小體,誘導心肌細胞焦亡
3.功能驗證:NLRP3炎癥小體介導的焦亡與AP藥物的心臟毒性密切相關
為了評估NLRP3炎性小體介導的心力衰竭是否與AP藥物誘導的心臟毒性作用有功能關聯,作者使用NLRP3抑制劑/Casp1抑制劑發現其限制了炎癥反應和心臟的纖維化。焦亡效應基因GSDMD的敲除實驗也減少了炎癥浸潤和纖維化。綜上表明NLRP3炎癥小體介導的焦亡與AP藥物的心臟毒性密切相關。
為了評估NLRP3炎性小體介導的心力衰竭是否與AP藥物誘導的心臟毒性作用有功能關聯,作者使用NLRP3抑制劑/Casp1抑制劑發現其限制了炎癥反應和心臟的纖維化。焦亡效應基因GSDMD的敲除實驗也減少了炎癥浸潤和纖維化。綜上表明NLRP3炎癥小體介導的焦亡與AP藥物的心臟毒性密切相關。
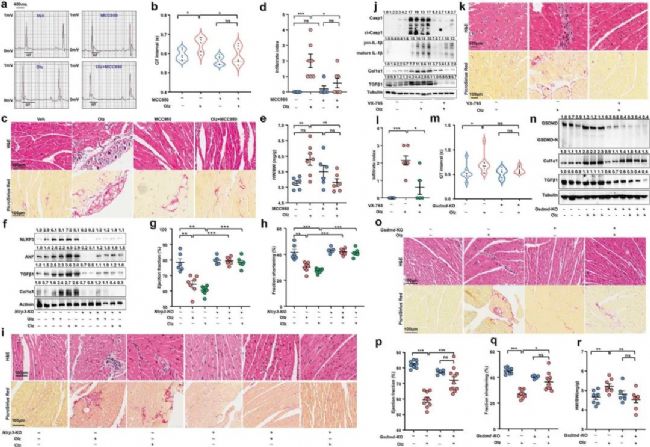
圖3 NLRP3炎癥小體介導的焦亡與AP藥物的心臟毒性密切相關
4.機制解析(藥物靶標蛋白):CB1R是AP藥物的直接靶點,對NLRP3炎性小體起重要調控作用
為了揭示AP藥物激活焦亡的主要機制,研究人員分別進行了轉錄組和蛋白質組的分析及聯合分析。根據聯合分析中共有的9條通路分別加入不同的抑制劑處理,結果發現內源性Cannabinoids對于Olz誘導的NLRP3炎癥小體的表達具有顯著的抑制效果。而Cannabinoid receptor 1, Cb1r是內源性Cannabinoids的受體,故作者進一步驗證了CB1R是否為AP藥物的直接靶點。結果表明在Olz、Clz或Que暴露的小鼠原代心肌細胞中CB1R的表達均被促進,且 AP藥物(Olz和Clz)可直接結合CB1R,并與主要的內源性Cannabinoids(2-AG和AEA)在與CB1R結合時存在競爭結合模式。此外,研究發現AP藥物與CB1R結合后,通過CB1R的 S426或S430位點磷酸化而促進了CB1R由膜轉位至胞漿(內化)。另外研究發現,CB1R的過表達增強了NLRP3炎癥小體蛋白的表達。綜上所述,CB1R是NLRP3炎性小體的上游調節劑。
為了揭示AP藥物激活焦亡的主要機制,研究人員分別進行了轉錄組和蛋白質組的分析及聯合分析。根據聯合分析中共有的9條通路分別加入不同的抑制劑處理,結果發現內源性Cannabinoids對于Olz誘導的NLRP3炎癥小體的表達具有顯著的抑制效果。而Cannabinoid receptor 1, Cb1r是內源性Cannabinoids的受體,故作者進一步驗證了CB1R是否為AP藥物的直接靶點。結果表明在Olz、Clz或Que暴露的小鼠原代心肌細胞中CB1R的表達均被促進,且 AP藥物(Olz和Clz)可直接結合CB1R,并與主要的內源性Cannabinoids(2-AG和AEA)在與CB1R結合時存在競爭結合模式。此外,研究發現AP藥物與CB1R結合后,通過CB1R的 S426或S430位點磷酸化而促進了CB1R由膜轉位至胞漿(內化)。另外研究發現,CB1R的過表達增強了NLRP3炎癥小體蛋白的表達。綜上所述,CB1R是NLRP3炎性小體的上游調節劑。
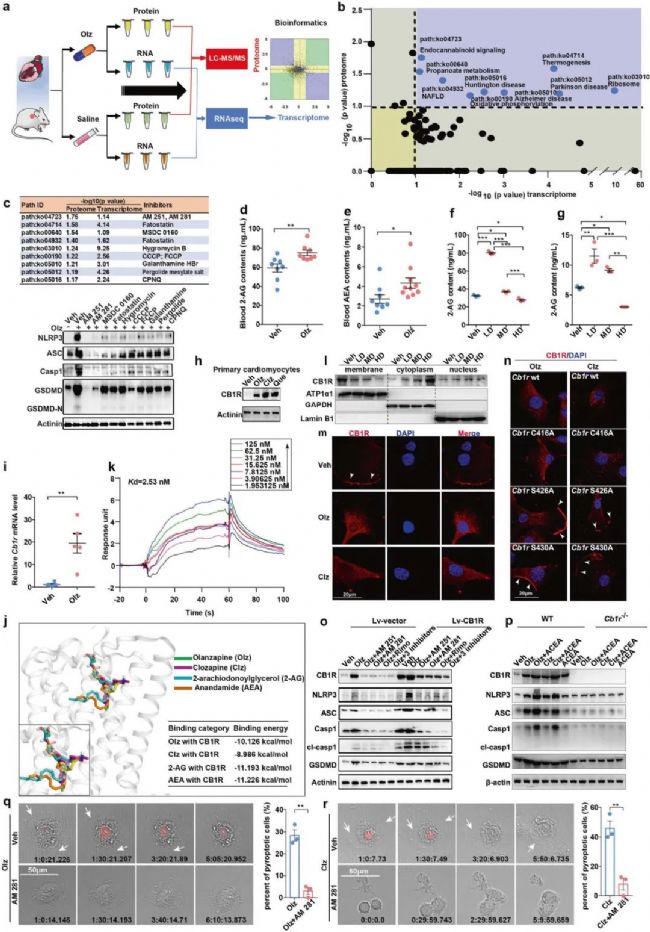
圖4 CB1R是AP藥物的直接靶點,且是NLRP3炎性小體的上游調節劑
5. 機制解析(上下游蛋白的互作分析):CB1R通過177-209氨基酸殘基與NLRP3炎癥小體相互作用并阻止其降解
為研究CB1R是否影響焦亡蛋白的合成或降解,作者使用蛋白質合成抑制劑CHX并結合CB1R的過表達或敲除進行研究,結果表明CB1R通過抑制NLRP3炎癥小體的降解來穩定NLRP3炎癥小體。此外,通過免疫共沉淀實驗證實除ASC外,CB1R與NLRP3、Casp1和GSDMD存在直接的物理相互作用,結合區域為CB1R的177-209氨基酸殘基。綜上所述,CB1R內化后通過與NLRP3炎癥小體主要成分直接相互作用穩定了NLRP3炎癥小體。
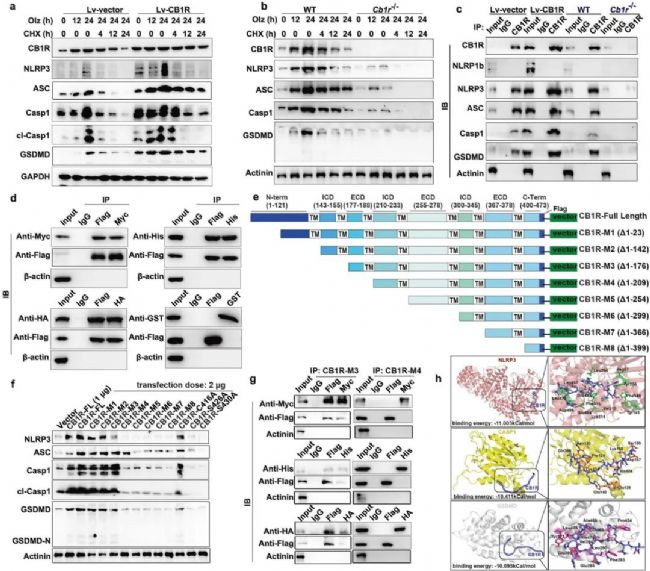
圖5 CB1R通過177-209氨基酸殘基與NLRP3炎癥小體相互作用并阻止其降解
6. 功能驗證:Cb1r基因敲除改善AP藥物誘導的焦亡和心臟毒性
為驗證CB1R在AP藥物誘導的焦亡和心臟毒性中的作用,作者將Cb1r基因敲除,研究發現Olz和Clz刺激后,Cb1r敲除小鼠表現為正常心功能,未表現出心臟重塑、纖維化組織積累等。而當Cb1r基因過表達時,則相反,影響了心臟功能。
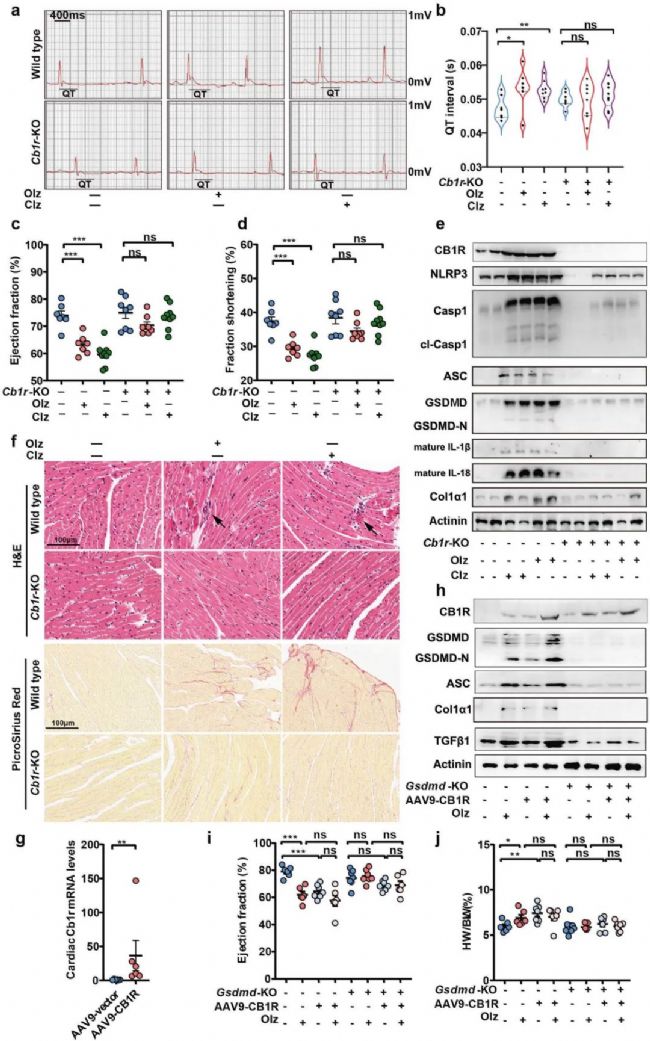
圖6 Cb1r基因敲除改善AP藥物誘導的焦亡和心臟毒性
7. 藥物篩選:CB1R抑制劑保護小鼠免受AP藥物的心臟毒性而不引起額外的副作用
為探究CB1R抑制劑在小鼠模型中的保護心臟的能力,作者檢測了CB1R拮抗劑AM251和AM281的體內治療效果。結果發現AM251或AM281處理小鼠后,炎癥小體數量明顯減少、活性受損、抑制了焦亡蛋白和纖維因子,同時心臟功能也得到了改善,此外也未引起額外的副作用。綜上所述AM 251和AM 281可能在保護心臟免受抗精神病藥物心臟毒性方面發揮更安全的作用。
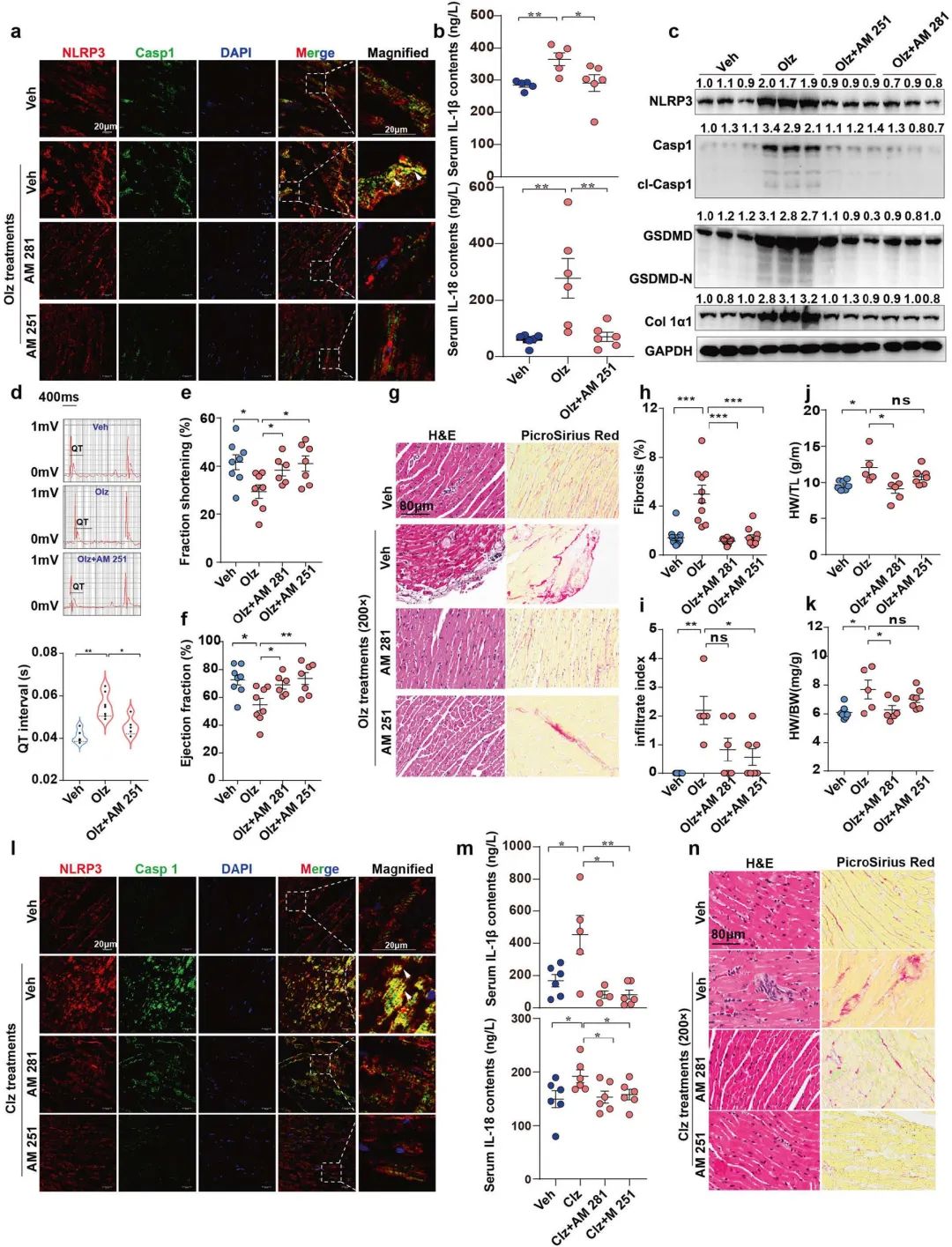
圖7 CB1R抑制劑保護小鼠免受AP藥物的心臟毒性而不引起額外的副作用
8. 臨床驗證:在人心臟標本中,CB1R的表達與AP藥物誘導的焦亡和纖維化程度呈正相關
最后作者在人心臟標本中評估了CB1R調節NLRP3炎性小體的臨床轉化潛能。在真實的尸檢病例中,長期使用Clz或Olz的患者心臟中,有顯著的NLRP3炎性小體斑點、大量纖維組織積累,且NLRP3炎性小體斑點的數量或GSDMD表達量與心臟纖維化程度顯著相關、CB1R表達與纖維化程度、NLRP3炎性小體數目和GSDMD表達也具有良好的相關性。綜上所述, CB1R的異常表達與抗精神病藥物誘導的人類心臟細胞焦亡和纖維化相關。
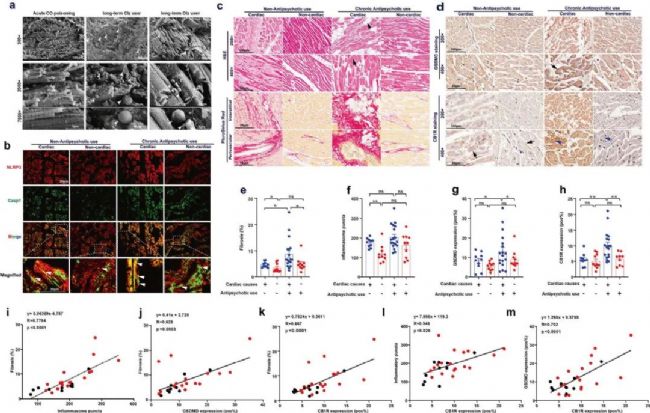
圖8 人類心臟標本中,CB1R表達與抗精神病藥物誘導的的焦亡和纖維化正相關
小結
本研究發現NLRP3炎性小體介導的焦亡是AP藥物誘發心臟毒性的主要因素。NLRP3炎性小體的活性受CB1R控制,CB1R通過S426和S430內化,并通過其177-209區域與NLRP3炎性小體發生物理相互作用,導致NLRP3炎性小體穩定,并激活細胞焦亡,最終導致AP藥物的心臟毒性。此外,實驗證實CB1R的抑制劑可保護小鼠免受AP藥物的心臟毒性且不引起額外的副作用。

標簽:
蛋白質組學
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





