抗體藥物重要靶點:血管內皮生長因子VEGF的介紹與應用
1983 年,Senger等發現豚鼠肝癌細胞分泌了促進血管內皮細胞生長的肽類物質,遂根據其生物學效應將其命名為血管通透因子(Vascular permeability factor, VPF);1989 年,Farrara等從垂體中分離和克隆了該類物質,并將其統一命名為血管內皮生長因子(Vascular endothelial growth factor, VEGF)。VEGF最開始的功能主要是促進血管內皮細胞增殖、血管形成以及血管通透性增加等作用,隨著研究的深入,科學家們發現VEGF還具有免疫調節、神經保護、組織修復等多種功能。
VEGF家族成員
VEGF-A、VEGF-B、VEGF-C、VEGF-D、PGF
在人體組織中,血管內皮生長因子VEGF超家族由5個成員組成:VEGF-A、VEGF-B、VEGF-C、VEGF-D、PGF(planta growth factor,胎盤生長因子)。人們通常說的VEGF主要指VEGF-A。VEGF-A可促進新生血管形成和使血管通透性增加;VEGF-B在非新生血管形成的腫瘤中起作用;VEGF-C和VEGF-D在癌組織的新生血管和新生淋巴管的形成過程中起作用;PGF也是一種潛在的新生血管形成因子,PGF能促進新生血管形成,使血管通透性增加,在實驗性脈絡膜新生血管中PGF的表達明顯增高[1]。
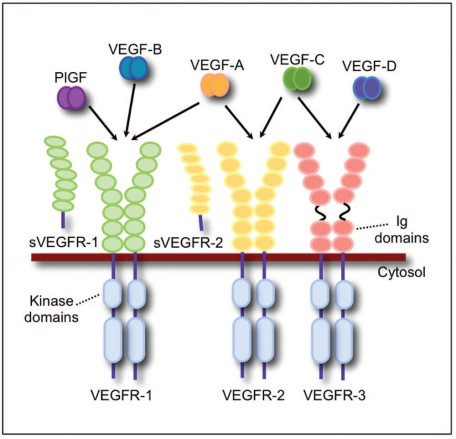
VEGF家族及受體成員
VEGF家族成員由多個外顯子編碼,在經溶解和與受體結合以后,經過剪切生成不同的亞型(比如:VEGF-A有七個亞型,VEGF-A基因轉錄形成的前體mRNA 通過可變剪接,可形成不同片段的VEGF-A 蛋白,分別為VEGF121、VEGF145、VEGF165、VEGF110、VEGF183、VEGF189和VEGF209等;而 VEGFB有VEGFB_(167)和VEGFB_(186)兩個亞型),從而導致溶解度與受體結合位置出現一定的變化。
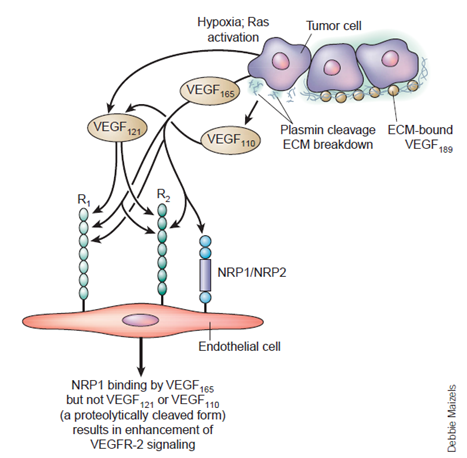
不同亞型VEGF-A與受體的結合
VEGF家族成員通過與膜結合的酪氨酸激酶受體來實現細胞內的信號轉導:VEGF-A 和 VEGF-B有時候會更加傾向于和VEGFR-1受體結合;VEGF-A,VEGF-C, VEGF-D 與PGF有時候會傾向于和VEGFR-2受體結合;VEGF-C和VEGF-D有時候更加傾向于和VEGFR-3受體(僅僅是在造血細胞中表達)結合。
VEGF在新血管的形成中扮演著及其重要的角色。VEGF可以誘導已經存在的血管或者新生血管的發育,因此是胚胎發育和血管修復的關鍵。它會增加血管通透性,促進淋巴內皮細胞生長。
胚胎發育過程中,可觀察到 VEGF 高表達。在此過程中,VEGF 與多種胚胎發育因子協同控制新血管的形成[2]。因此,如果生物體內的 VEGF 通路中斷,由于循環問題導致的致死率將增加[3]。出生后,VEGF 的表達顯著減少。但是,在進行傷口愈合或骨折修復的組織中,VEGF 的局部表達水平會上調[4]。
一旦血管生成開關經誘導后開啟,將促進新血管形成,后續還會發生一系列復雜并且受到嚴密調控的反應。這種通路通過激活多種蛋白酶來促進已有血管周圍的基底膜降解。隨后,內皮細胞增殖作用加強,管腔和新的基底膜形成,新生成的血管相融合[4]。
VEGF應用研究
氣道損傷修復、iPSC分化
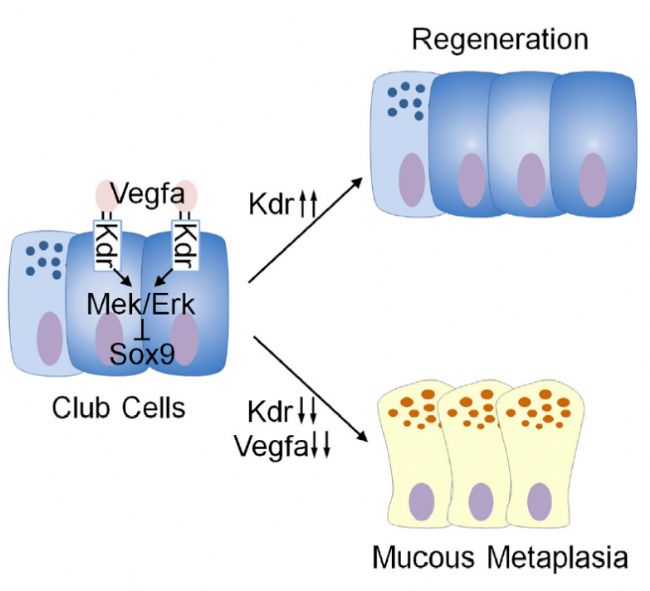
2021年5月18日,浙江大學醫學院附屬兒童醫院蔣明研究員與哥倫比亞大學醫學院闕建文教授在知名學術期刊《Developmental Cell》在線發表了論文“VEGF receptor 2 (KDR) protects airways from mucus metaplasia through a Sox9 dependent pathway ”[5],首次發現了血管內皮生長因子信號通路(VEGF signaling pathway)在肺氣道上皮損傷后再生和氣道疾病病理過程中起重要的調控作用,為此類疾病的治療提供了新的思路和方向。

這項研究首次發現了VEGF信號通路在內胚層起源器官中的功能。不同于當前主流的炎癥及免疫反應的作用,研究人員創新性地將VEGF信號通路引入了肺粘液化生發病機制領域。他們的發現對抑制呼吸道疾病的粘液化生提供了新的理論基礎和治療策略。
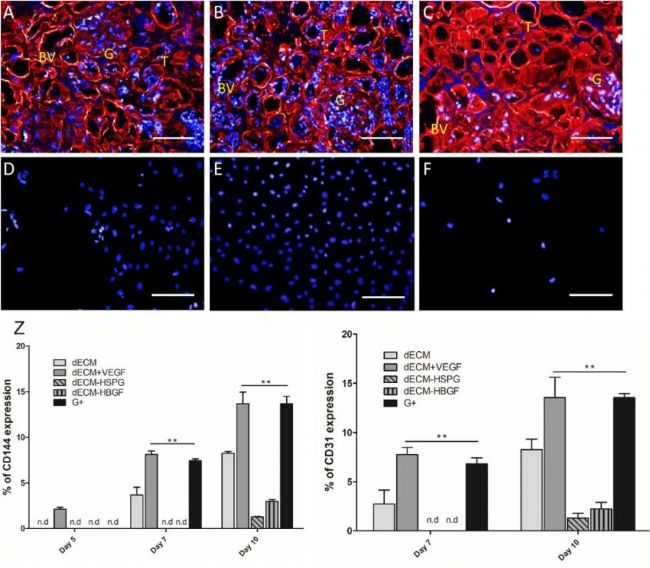
2019年6月18日,德國柏林夏里特大學Andreas Kurtz教授團隊在《Biomaterials》期刊上發表了論文“VEGF-Supplemented extracellular matrix is sufficient to induce endothelial differentiation of human iPSC”[6]。Andreas Kurtz教授團隊檢測了dECM及其相關因子、血管內皮生長因子VEGF對人類誘導多能干細胞(hiPSC)向內皮細胞分化的調節作用。研究結果表明,清除HBGFs或ECM中的硫酸乙酰肝素蛋白聚糖(HSPG)會削弱dECM對hiPSC分化的誘導作用;相反,補充VEGF會增強dECM上hiPSC向成內皮細胞的分化。

為了證實去除HSPG和HBGF以及補充血管內皮生長因子(VEGF)對dECM的影響,研究者考察了HUVEC的生存能力和代謝活性。結果表明,HUVECs大部分位于腎小管和血管層粘連蛋白豐富的基質結構上,或毛細血管豐富的腎小球內,而在無基質成分的腔內區很少發現細胞。這種特異性在dECM + VEGF中最為明顯,而在dECM- HSPG中,細胞呈現隨機附著狀態 。
VEGF關于腫瘤研究
腫瘤篩查、靶向藥物
VEGF同樣對于腫瘤生長具有促進作用,是腫瘤新血管生成中最重要的生長因子之一。1971年哈佛大學兒童醫院J.FolKman教授帶領的研究團隊經過大量研究發現:在沒有血管生成的情況下,實體腫瘤單純依靠彌散獲取氧氣及營養物質,生長范圍只能維持在1-2mm²;腫瘤組織生長范圍超過2-3mm²時,必須依靠血管生成來提供足夠的氧氣和營養物質維持腫瘤組織的快速生長,血管生成是腫瘤生長和轉移的基礎,這就是著名的FolKman學說,1990年,這一假說也在業內得到證實。
VEGF表達量的監測可作為健康人群常規體檢方式實現早癌篩查,早診早治。VEGF也可作為臨床科室的監測指標,以評估患癌的風險,提高癌癥治愈率,降低醫療成本。針對有特異性腫瘤標志物的腫瘤類型(如AFP、PSA),聯合VEGF檢測能夠明顯提高臨床診斷的靈敏度。
VEGF具備廣譜性,能覆蓋160余種組織類型癌種。它可以篩查幾乎所有實體瘤和部分非實體瘤,聯合其他腫瘤檢測技術,能夠顯著提高腫瘤篩查的靈敏度。在影像學檢測中,當腫瘤大小至少到1cm以上時才容易被發現,此時腫瘤細胞已達10億級以上;免疫學檢測在腫瘤細胞達到百萬個以上數量時才可能被檢出。VEGF在腫瘤形成初期就異常升高,檢測VEGF對癌癥風險的預警更早、更及時。
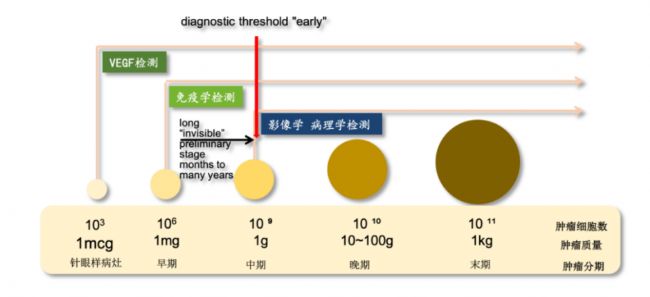
目前,由于多種癌癥中VEGF信號通路的激活,已經有100多種抗體藥處于各種研發階段,而其中的多款單抗藥物已經上市,針對這一靶點的雙抗藥物也在積極的開發中。覆蓋的疾病包含了腫瘤特別是實體瘤、視覺性疾病以及心血管疾病等多種類型,具有很大的應用潛力。

隨著科研人員對VEGF在腫瘤治療領域研究工作的深入,靶向調控VEGF通路已經在癌癥治療中顯示出其臨床應用的重要性。然而,需要注意的是,這些靶向藥物也存在著一定的局限性。但VEGF信號傳導途徑仍然是癌癥治療的重要靶標,進一步了解這些藥物的機制對于改善癌癥患者的治療至關重要。
綜上所述,VEGF作為特異性最強的促血管生成因子,對促進受損器官及細胞修復具有重要意義。鑒于其在腫瘤血管及淋巴管生成和生長中的作用,以VEGF及其受體為靶向的抗腫瘤療法有望成為抗腫瘤的重要手段。尤其值得一提的是,血管生成過程極其復雜,VEGF并不是唯一能夠促進血管生成的因子,它與其他促血管生成因子的關系仍需持續關注和進一步研究。
同立海源細胞培養蛋白推薦 >>
|
貨號 |
產品名稱 |
|
GMP-TL401 |
重組人bFGF蛋白 |
|
GMP-TL612 |
重組人VEGF 165蛋白 |
|
GMP-TL505 |
重組人FLT3 Ligand蛋白 |
|
GMP-TL504 |
重組人SCF蛋白 |
|
GMP-TL644 |
重組人PDGF-BB蛋白 |
|
GMP-TL643 |
重組人TGF-β1蛋白 |
|
GMP-TL634 |
重組人BMP-2蛋白 |
|
GMP-TL607 |
重組人BMP-4蛋白 |
|
GMP-TL638 |
重組人IGF-1蛋白 |
|
GMP-TL633 |
重組人LIF蛋白 |
|
GMP-TL636 |
重組人EPO蛋白 |
|
GMP-TL651 |
重組人Vitronectin蛋白 |
|
GMP-TL650 |
重組人TPO蛋白 |
|
GMP-TL511 |
重組人IL-3蛋白 |
|
GMP-TL512 |
重組人IL-6蛋白 |
|
GMP-TL765 |
重組人HGF蛋白 |
|
GMP-TL683 |
重組人Oncostatin M 蛋白 |
|
GMP-TL613 |
重組人EGF蛋白 |
參考資料:
[1]Samson M, et al. (2004) Human endocrine gland-derived vascular endothelial growth factor: expression early in development and in Leydig cell tumors suggests roles innormal and pathological testis angiogenesis. J Clin Endocrinol Metab, 89(8):4078–4088.
[2]Gilbert, SF (2000) Developmental biology (6th Edition). Sunderland (MA): Sinauer Associates.
[3]Ji Y, Lu X, Zhong Q, Liu P, An Y, Zhang Y, Zhang S, Jia R, Tesfamariam IG, Kahsay AG, Zhang L, Zhu W, Zheng Y (2013). Transcriptional profiling of mouse uterus at pre-implantation stage under VEGF repression. PLoS One. 8(2):e57287.
[4]Adair, TH and Montani JP (2010) Angiogenesis. San Rafael (CA): Morgan & Claypool Life Sciences; 2010.
[5]Ming Jiang,Yinshan Fang,Yu Li,Jianwen Que,et al. VEGF receptor 2 (KDR) protects airways from mucus metaplasia through a Sox9 dependent pathway.Developmental Cell.VOLUME 56, ISSUE 11, P1646-1660.E5,2021.
[6]Imran Ullah, Raed Abu-Dawud, Jonas Felix Busch, Anja Rabien, Bettina Erguen, Iris Fischer, Petra Reinke, Andreas Kurtz*. VEGF-Supplemented extracellular matrix is sufficient to induce endothelial differentiation of human iPSC. Biomaterials 2019, DOI: 10.1016/j.biomaterials.2019.119283.





