從工程化CAR-T細胞等方面入手探討CAR-T細胞相關毒性問題的解決策略

上一期我們提到,嵌合抗原受體(CAR)-T細胞療法在治療表達CD19的復發/難治性B細胞惡性腫瘤方面已經非常成功,但在臨床應用中仍存在多種毒性作用,如細胞因子釋放綜合征(CRS)、免疫效應細胞相關神經毒性綜合征(ICANS)等。毒副作用是目前限制CAR-T療效的重要因素,通過增加劑量或提高效應活性以增強抗腫瘤作用的方法受到阻礙。
那么,應該如何打破困局?有什么提升治療效果的應用策略呢?我們可以從工程化CAR-T細胞、改變CAR分子結構、降低CAR免疫原性、“關閉開關”這幾個方面入手,共同探討CAR-T細胞相關毒性問題的解決策略。

01 工程化CAR-T細胞
為了獲得有效的治療反應,CAR-T細胞抗原結合結構域必須結合其靶表位并達到誘導CAR-T細胞活化和細胞因子分泌的最低閾值水平,但也不能超過最高閾值時,否則會產生毒性水平的細胞因子和免疫系統激活。CAR-T細胞活化和活化動力學的程度受多種因素的影響,包括但不限于腫瘤細胞上抗原表達水平、腫瘤負荷、抗原結合結構域與其靶表位的親和力以及CAR的共刺激結構域。因此,有必要優化CAR模塊化結構,以改善治療效果和限制毒性。
02 改變CAR分子結構
降低CAR-T細胞抗原結合域的親和力是降低毒性的一種重要途徑,這將導致對腫瘤細胞上更高抗原密度的需求增加,以實現高水平的活化,能規避對抗原含量相對較低的健康組織的影響。通過修飾鉸鏈和跨膜區來改變活化的CAR-T細胞調節細胞因子分泌,也可以達到降低毒性的目的。
另外,共刺激結構域在CAR設計中提供了另一個可修飾的結構區域,可以根據腫瘤類型、腫瘤負荷、抗原密度、靶抗原-抗原結合結構域進行定制。具體而言,含有4-1BB結構域的CAR-細胞具有較低的毒性風險、較高的T細胞耐力和較低的T細胞擴增峰值水平,而含有CD28的則體現為活化速度更快、強度更高,但其衰竭速度也更快,持久性不足。
03 CAR免疫原性
在細胞因子相關毒性的產生中,宿主免疫系統對CAR的識別可能有重要作用,因此,可以利用人或人源化抗體片段而不是鼠源性抗體片段來降低CAR免疫原性。此外,也可以通過優化鉸鏈/跨膜結構域以降低CAR的免疫原性,并且有趣的是,CAR-T細胞持久性也可能得到改善。
04 給CAR-T細胞裝上開關
改善CAR-T細胞毒性的另一個潛在途徑是通過實施“關閉開關”或自殺基因策略。這將有助于通過二級誘導劑,在不良事件發生時選擇性降低CAR-T細胞的功能。基于該理念,目前已經開發了可以調控CAR-T細胞功能的方法,如誘導型Casp9,在一項臨床試驗中,它在30分鐘內消除了超90%的CAR-T細胞。
自殺策略或其他類似方法的最大限制是,它們的使用會突然停止對快速進展的疾病的治療。一種具有潛力的解決方法是使用達沙替尼(一種酪氨酸激酶抑制劑),其功能是通過抑制近端TCR信號激酶來抑制T細胞的活化。在臨床前模型中,達沙替尼能快速且可逆地阻止CAR-T細胞的活化,并且在CAR-T細胞輸注后,早期給予達沙替尼可顯著降低其他致命CRS小鼠的死亡率。這種方法可暫時抑制了CAR-T細胞功能,并且在毒性消退后挽救CAR-T細胞療法。
CAR-T細胞治療展望
盡管當前CAR-T細胞治療在毒副作用、耐藥性等方面存在諸多挑戰,藥物安全性面臨考驗,但隨著CAR分子設計的不斷優化,以及聯合療法開發,相信CAR-T細胞治療的應用會到達一個更為高效安全的水平。
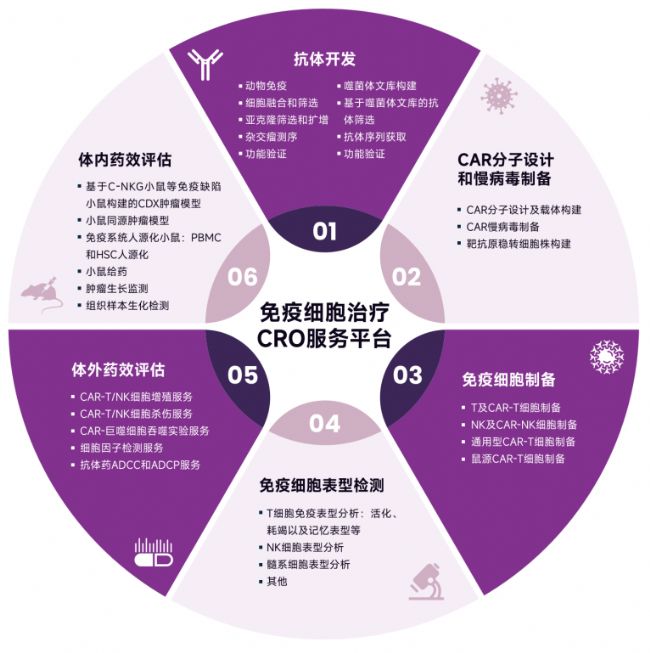
基于多年在腫瘤免疫領域的研究經驗,賽業生物可為CAR-T/其它細胞治療研究者提供研發的全方位支持,從抗體開發、CAR病毒制備、免疫細胞制備和表型檢測,到細胞模型與動物模型的構建、體外/體內藥效評價一應俱全。
參考文獻:
[1] Sterner RC, Sterner RM. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer J. 2021 Apr 6;11(4):69. doi: 10.1038/s41408-021-00459-7. PMID: 33824268; PMCID: PMC8024391.





