mRNA遞送平臺SEND助力CRISPR-Cas9向細胞遞送和完成基因編輯
2021年8月19日,張鋒團隊在國際頂尖學術期刊Science上發表了題為:Mammalian retrovirus-like protein PEG10 packages its own mRNA and can be pseudotyped for mRNA delivery 的研究論文。

研究團隊開發了一種全新的RNA遞送平臺——SEND(Selective Endogenous eNcapsidation for cellular Delivery),SEND的核心是逆轉錄病毒樣蛋白PEG10,它能夠與自身的mRNA結合并在其周圍形成球型保護囊。研究團隊將其改造設計后用來包裝和遞送RNA,使用SEND系統將CRISPR-Cas9基因編輯系統遞送給小鼠和人類細胞并成功編輯了目標基因,這將為基因治療提供一種全新的遞送載體。SEND系統是利用人類內的組分自組裝為病毒樣顆粒,與其他遞送載體相比,所引起的免疫反應更少,更具安全性。
哺乳動物細胞形成Gag同源物的計算篩選
為了鑒定具有轉移特定核酸潛力的基因,研究人員專注于包含核心衣殼(CA)結構域的Gag同源物,該結構域保護逆轉錄轉座子和外源逆轉錄病毒的基因組。基因組分析確定了哺乳動物基因組中的許多內源性Gag同源物,形成分泌在細胞外囊泡內的衣殼樣顆粒(EVs)。

圖1 鑒定形成衣殼并被分泌的哺乳動物逆轉錄元件衍生的Gag同源物
MmPEG10 結合并分泌其自身的mRNA
為了確定這些蛋白質是否在EV內分泌,研究人員在人胚胎腎(HEK)293 FT細胞中過表達每個含CA基因的表位標記小鼠直向同源物,并收集全細胞裂解物和病毒樣顆粒(VLP)。
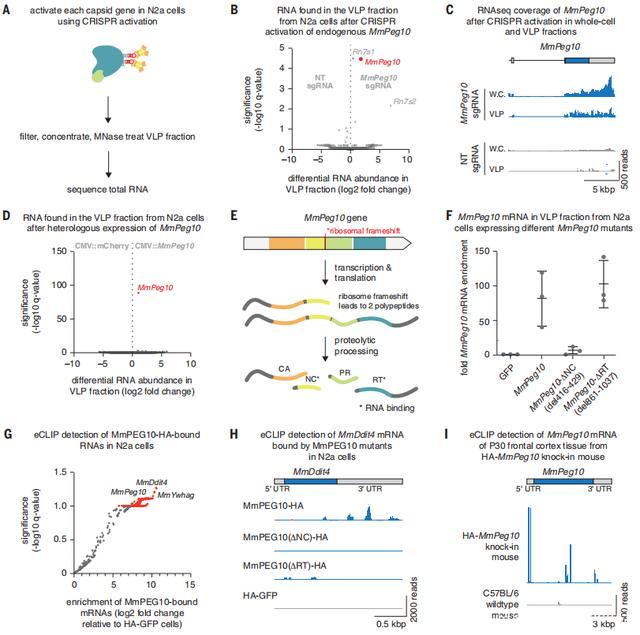
圖2 MmPEG10蛋白和mRNA在體外由細胞分泌到囊泡中
結果表明,MmMOAP1、MmArc、MmPEG10和MmRTL1都存在于VLP級分中,但MmPEG10是VLP級分中最豐富的蛋白質。此外,內源性MmPEG10,很容易在無細胞成年小鼠血清中檢測到。
接下來,研究人員使用RNA測序測試了由Gag同源物形成的任何衣殼樣顆粒是否包含特定的mRNA。發現MmPeg10轉錄激活導致可觀數量的全-VLP部分中的長度MmPeg10 mRNA轉錄本。

圖3 帶有MmPeg10的5和3’UTR的側翼mRNA能夠將mRNA功能性地細胞間轉移到靶細胞中
PEG10是一個進行RNA傳遞的模塊化平臺
為了生成完全內源性的SEND系統,研究人員測試了VSVg是否可以被內源性融合跨膜蛋白替代。鑒于MmPeg10/HsPEG10和合胞素基因的重疊組織表達,還測試了用MmSYNA或MmSYNB對小鼠SEND系統進行假型與使用VSVg進行假型的可行性。結果表明,這種細胞類型適合通過這些融合素進行轉導。
研究人員將轉導增強劑vectofusin-1添加到MmSYNA和MmSYNB顆粒的上清液中,以增強體外轉導。在這些原代細胞中,VSVg和MmSYNA都啟用了SEND介導的Mm.cargo(Cre)功能轉移,而MmSYNB則沒有。
同樣,這種包裝是高度特異性的,因為只有UTR側翼的mRNA[即Mm.cargo(Cre)]被功能轉移。與MmSYNA一起,SEND可以配置為功能基因轉移的完全內源系統。
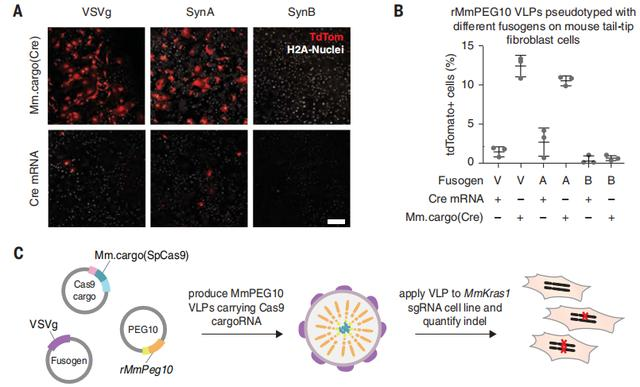
圖4 SEND 是一個模塊化系統,能夠將基因編輯工具傳遞到人類和小鼠細胞中
之后研究人員開始探索MmPEG10介導的MmPeg10 RNA在神經元中的內源性作用。攜帶天然PEG10轉錄本的MmSYNA假型VLP的功能轉移到原代小鼠皮層神經元,導致許多參與神經發育的基因上調。
為了進一步表征該系統組件的模塊化,研究人員測試了不同的貨物RNA。測試了SEND 是否可以介導大約5kb Mm.cargo(SpCas9)的功能轉移到N2a細胞系中,這些細胞系組成性表達針對MmKras的單一向導RNA(sgRNA)。
SEND能夠在功能上轉移SpCas9,導致受體細胞中約60%的插入和缺失(indels);與Cre的結果相似,SEND是特異性的,只能有效地功能轉移SpCas9,兩側是全長或優化的Peg10 UTR序列。
為了創建用于遞送sgRNA和SpCas9的多合一載體,研究人員測試了SEND是否可以有效遞送sgRNA。并將它們與表達Cas9的N2a細胞一起孵育;即使直接轉染向導顯示強大的插入缺失形成,也可以檢測到非常少的活性。

圖5 SEND是一個模塊化系統,能夠將基因編輯工具傳遞到人類和小鼠細胞中
作者表示SEND技術可以補充現有的病毒遞送載體和脂質納米顆粒,以擴展向細胞遞送基因和編輯療法的工具箱。
參考文獻





