小動物活體成像實驗流程和方法
動物模型是現代生物醫學研究中重要的實驗方法與手段,有助于更方便、更有效地認識人類疾病的發生、發展規律和研究防治措施。動物活體成像技術主要分為光學成像、核素成像、核磁共振成像MRI、計算機斷層攝影CT成像和超聲成像五大類。其中可見光成像和核素成像特別適合研究分子、代謝和生理學事件,稱為功能成像;超聲成像和CT則適合于解剖學成像,稱為結構成像,MRI介于兩者之間。
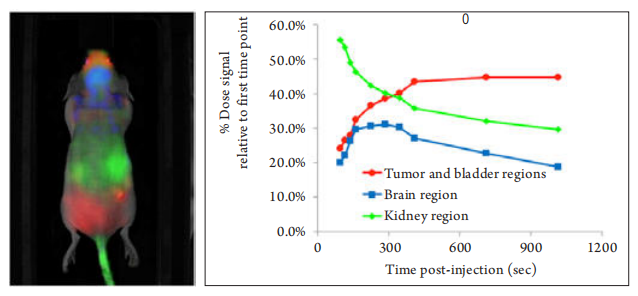
可見光成像是小動物活體實驗最常見的成像方式,包括生物發光與熒光兩種技術。生物發光是用熒光素酶基因標記DNA,利用其產生的蛋白酶與相應底物發生生化反應產生生物體內的光信號。而熒光技術則采用熒光報告基因或熒光染料等新型納米標記材料進行標記。前者是動物體內的自發熒光,不需要激發光源,而后者則需要外界激發光源的激發。
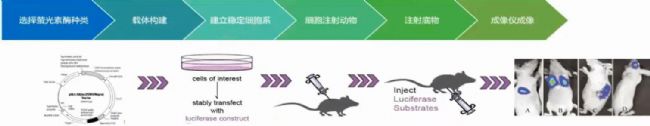
今天帶大家一起來看一下小動物活體成像實驗流程,主要分為三大部分:
一,進行光學標記;
二,構建動物模型;
三,活體動物成像
具體細分為:
1、選擇合適的熒光素酶
2、進行載體構建
3、建立穩轉細胞系
4、細胞注射動物
5、注射底物
6、進行活體成像
1、光學標記
(1)質粒的擴增和純化
制備帶有熒光素luc轉酶報告基因或編碼熒光蛋白基因的真核表達質粒并進行擴增純化。
(2)細胞轉染
取對數生長期的目標細胞,將細胞接種于6孔板內,待細胞融合度達到80%~90%孔培養板中,即可轉染。進行轉染時,將目標細胞、脂質體轉染試劑及足量的質粒載體懸浮液共培養6h,之后補充新鮮的培養液。也可采用Neucleofector電轉染的方式,能夠縮短轉染時間,獲取更高轉染效率的細胞。
(3)單克隆細胞篩選
轉染48h后用胰酶消化細胞,以1:6比例接種到6孔板中,同時加入抗生素G418,隨后每2d更換一次培養基并維持G418篩選直至單細胞抗性克隆的出現。分別挑選單一抗性克隆至96孔板,待其逐漸增殖后轉入24孔板中繼續傳代培養。
(4)熒光素酶活性鑒定陽性克隆,篩選穩定高表達的細胞株
單一抗性克隆傳代至第五代時用Luciferase Assay System檢測熒光素酶活性。檢測時,各克隆按1×10^5個/孔接種到24孔板,24h后細胞裂解液裂解,12000r,4℃離心10min,收集裂解物,取上清10μl加入96孔白板中,向每孔加入50μl熒光素酶連續讀底物,停留2s后,取10s的熒光值(RLU),每個克隆設3個復孔,保留RLU值高的細胞克隆繼續傳代培養,再過5代后進行熒光素酶活性檢測。保留RLU值維持較高的克隆直至第30代,熒光素酶活性最高的幾個克隆MCF-7-luc即為陽性克隆。將篩選出高效表達,陽性率接近100%的細胞株進行培養。
2、構建動物模型
根據實驗目的選擇尾靜脈注射、皮下移植、原位移植等方法接種已標記的細胞。
3、活體成像
(1)小鼠經過麻醉系統被麻醉后放入成像暗箱平臺,軟件控制平臺的升降到一個合適的視野,自動開啟照明燈拍攝第一次背景圖。(為了降低光吸收,建議大家對成像小鼠做脫毛處理)
(2)自動關閉照明燈, 在沒有外界光源的條件下拍攝由小鼠體內發出的光,即為生物發光成像。與第一次的背景圖疊加后可以清楚的顯示動物體內光源的位置,完成成像操作。熒光成像應選擇合適的激發和發射濾片,生物發光則需要成像前體內注射底物激發發光。
(3)利用軟件完成圖像分析過程。使用者可以方便的選取感興趣的區域進行測量和數據處理及保存工作。當選定需要測量的區域后,軟件可以計算出此區域發出的光子數,獲得實驗數據。