腫瘤壞死因子alpha(TNF-α)在細胞凋亡和存活及腫瘤治療中的作用
腫瘤壞死因子alpha(TNF-α)是一種由157個氨基酸組成的 17-kDa 蛋白質,為免疫細胞產生的多功能細胞因子,在細胞凋亡和存活以及免疫和炎癥中發揮關鍵作用[1]。
它主要由活化的巨噬細胞、T 淋巴細胞和自然殺傷 (NK) 細胞分泌,但是在包括成纖維細胞,平滑肌細胞和腫瘤細胞中也會有少量表達。腫瘤及其浸潤細胞在腫瘤微環境 (TME) 中釋放的炎性介質已被廣泛認為是癌癥的標志之一。有證據表明低濃度的促炎細胞因子表達與癌癥的嚴重程度以及不良預后相關。
TNF-α作為主要的炎性介質已被發現在婦瘤、消化系統腫瘤、泌尿系統腫瘤以及血液瘤中表達。在 20 世紀 70 年代后期人們發現TNF-α即具有抑制腫瘤細胞增殖,又具有誘導腫瘤生長的雙刃劍效應[2]:他一方面可以通過誘導癌細胞凋亡去抑制腫瘤細胞生長,但另一方面也刺激大多數對TNF誘導的細胞毒性具有抗性的癌細胞的增殖、存活、遷移和血管生成,從而導致腫瘤的發展發生。
一,TNF-α信號通路
TNF-α 通過兩種不同的受體發揮作用[3]。
TNF受體1(TNFR-1) (p60) 在所有細胞類型上表達,而TNF受體2 (TNFR-2) (p80) 局限在免疫細胞中表達。盡管TNF-α 對TNFR-2的親和力比對 TNFR-1高五倍,但TNFR-1才是啟動 TNF-α 大部分生物活性的關鍵[4]。兩種受體之間的主要區別在于只有TNFR-1即具有轉導細胞存活信號的能力亦有誘導細胞凋亡能力,但這種生死信號調節的作用機制至今也未被透徹理解[5]。
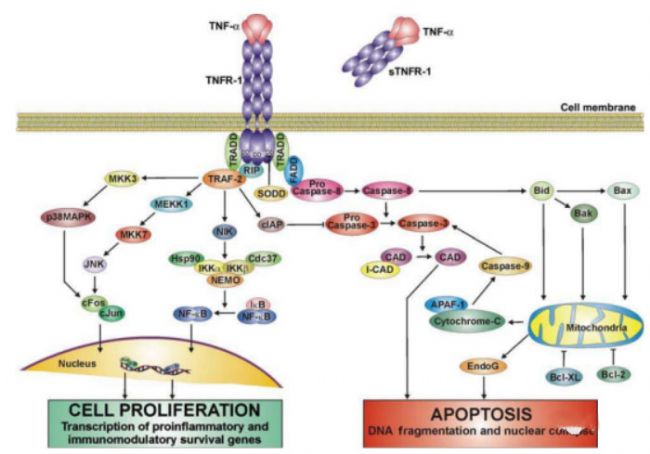
如圖1所示,當TNF-α與TNFR-1受體結合后,會招募TNFR相關死亡區域蛋白 (TRADD),銜接蛋白受體相互作用蛋白(RIP),TNFR相關因子2 (TRAF-2)和Fas相關因子死亡區域蛋白 (FADD) [6]。而這些銜接蛋白負責進一步細胞內信號傳導。當TNFR-1 發出細胞凋亡信號時,FADD被募集到復合物中,啟動導致細胞凋亡的蛋白酶級聯反應,最終導致細胞中DNA被切割,造成細胞凋亡[7]。當TNFR-1發出生存信號時,TRAF-2被募集到復合物中,在一系列蛋白酶激活后,通過細胞質凋亡蛋白抑制劑抑制細胞凋亡(cIAP)[8]。
而TRAF-2及RIP主要參與TNF誘導的 NF-κB 激活,而 NF-κB的靶基因以及其誘導的抗氧化錳超氧化物歧化酶 (MnSOD) 均被發現可以抑制細胞凋亡,在細胞的發生發展中起到關鍵作用,也同樣促進癌細胞的生長[9]。
二,TNF-α造成的腫瘤殺傷
TNF 在1975年被發現并于1984年成功克隆,因其高濃度注射到小鼠移植肉瘤中可以誘導腫瘤壞死而得名[10]。這種現象后被證實與 TNF 連接 TNFR1 時可以觸發腫瘤內皮細胞凋亡的能力相關[11]。但由于TNF治療引發的高毒副作用,很長時間無法在臨床上應用,直到兩個研究小組發現將高濃度的 TNF 灌注到黑色素瘤或肉瘤患者的孤立肢體上可以造成細胞殺傷且降低TNF治療帶來的不良反應[12]。
這些研究使得TNF的應用策略轉變為針對腫瘤細胞毒性的增強。例如一項在小鼠黑色素瘤和淋巴瘤模型中證明基因工程改造的TNF能夠通過抗腫瘤血管生成來抑制腫瘤生長[13];另一項研究證明對小鼠黑色素瘤內注射TNF和 IL-2 編輯的溶瘤病毒也增強了PD-1 抑制劑的療效[14]。
但TNF 對免疫激活的直接影響在多數情況下都是有限的,最近的一項動物研究表明,在過繼性T細胞轉移療法(ACT)中,由CD4+ T細胞產生的TNF只有與化療藥物聯用時才能對小鼠的淋巴瘤,結直腸癌以及乳腺癌造成腫瘤殺傷[15],因此抗原特異性 CD4+ T 細胞產生的TNF和化療抑制小鼠腫瘤且延長其生存的必備條件。
這些研究表明,即使在大量抗原特異性T細胞可以到達腫瘤的情況下,他們產生的TNF水平仍不足以殺死腫瘤細胞。目前TNF-α在腫瘤治療的發展方向多以重組形式與化療聯合用于肢體隔離熱灌注術(ILP)為主[16]。重組TNF-α在 ILP 中可以直接抑制腫瘤生長,且增加化療藥物對腫瘤組織的滲透。
因此TNF-α在治療腫瘤領域的發展方向多以作為促進劑而非直接參與腫瘤治療,目的是利用該藥物增加藥物輸送能力,因為這種細胞因子在腫瘤內的選擇性靶向以及毒性管理仍是待探究的問題。
三,TNF-α造成的腫瘤生長
F.Balkwill 教授是第一個直接將TNF與腫瘤生長聯系起來的,他觀察到在小鼠皮膚癌變模型中,TNF、TNFR1 和 TNFR2 的缺失可以顯著減少乳頭狀瘤的發展。目前已被證實在較低區間內的高水平TNF-α表達會促進腫瘤生長。在B16小鼠黑色素瘤模型中,癌細胞分泌的TNF 促進了腫瘤對骨髓細胞的浸潤以及內皮標志物的表達,從而促進腫瘤血管化和進展[17]。而體內研究表明使用靶向抗體阻斷 TNF/TNFR1 信號通路能夠增加微環境中黑色素瘤特異性 CD8+ T 細胞的比例并延緩腫瘤生長[18]。
另外,研究發現腫瘤相關TNF還可以影響癌細胞的分化。在接受 ACT 治療的黑色素瘤患者中觀察到TNF誘導腫瘤分化過程,減少黑色瘤生物標記物、降低免疫原性,促進腫瘤復發[19]。
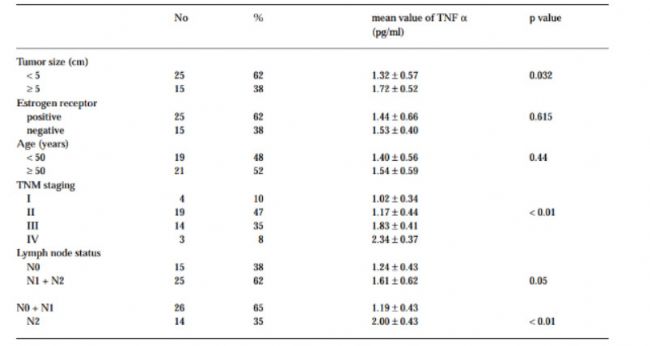
一項納入40例浸潤性乳腺癌患者前瞻性研究對比了患者血液樣本與30例相同年齡的健康女性血液樣本。研究表明浸潤性乳腺癌患者血清TNF-α平均值為1.47±0.58 pg/ml,比對照組的0.98±0.37 pg/ml顯著升高(P < 0.01)。且單變量分析顯示在腫瘤最大直徑≥5cm(P=0.03),TNM分期更晚(P<0.01)以及更晚期的淋巴結狀態 (P < 0.01) 的患者中血清TNF-α顯著升高[20](表1)。而在包括了肺癌和腎細胞癌的其他癌癥模型中也觀察到 TNF 參與上皮-間質轉化 (EMT),誘導腫瘤分化從而促進腫瘤發生[21-22]。
表1:與臨床病理變量相關的 TNF-α 血清濃度
總之,在癌癥進展過程中,TNF 不僅可以通過直接調節白細胞的活化、功能和存活去降低免疫療法的效果,還可以改變癌細胞的表型,使它表達免疫抑制分子以及對 T 細胞不可見,幫助免疫逃逸。
四,TNF-α對肝細胞癌的影響
肝細胞癌 (HCC) 是一種與炎癥相關的疾病。HCC 的發展和進展受遺傳、表觀遺傳和環境因素的影響。乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)是HCC 最普遍的危險因素之一。大約 70%-80% 的 HCC 與持續性病毒感染有關。
而巨噬細胞分泌的TNF-α作為一種促炎細胞因子,在惡性疾病的發病機制中發揮關鍵作用。一項大鼠動物研究發現 TNF-α直接參與HPC的激活,而HPC的激活通常與肝損傷的組織修復相關。因此TNF-α抑制和缺失可以通過增加肝細胞凋亡和減少肝細胞增殖來降低腫瘤發生率[23](圖2)。
而另一項收集了120例肝細胞癌患者的研究將臨床診斷分為復發組和未復發組以觀察IHC檢測的TNF-α表達,結果顯示復發組TNF-α表達水平顯著高于未復發組[24]。(0.25±0.01 vs 0.15±0.01, P<0.001,圖3A). 另外分析肝門區 p-STAT3 表達與腫瘤周圍組織 TNF-α之間的關系表明這兩組之間存在顯著正相關(P<0.01,r=0.452,圖 3B)。因此TNF-α與促進腫瘤生長以及導致HCC的不良預后息息相關。
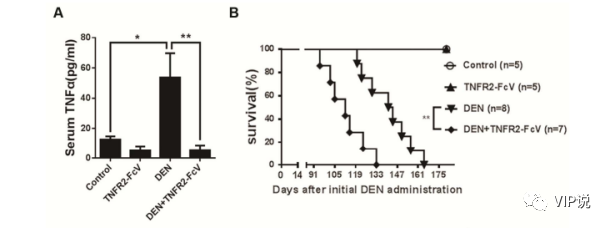
圖2:A 和 B. 免疫熒光染色顯示,EpCAM (A) 和 OV6 (B) 陽性在肝門區域的表達均因 DEN 處理(移植HCC細胞小鼠)而增加,而 DEN+TNFR2-FcV組(移植HCC細胞但同時做TNF抑制處理)的兩種標記物水平較低,這表明 HPC 激活可能需要 TNF-α。
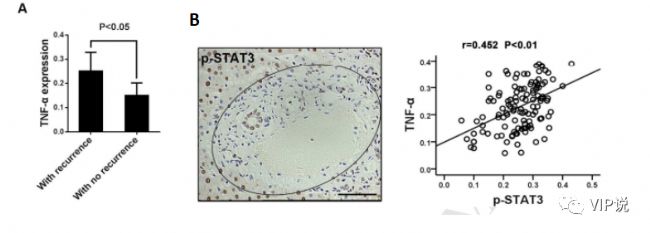
圖3:A. IHC檢測的瘤周組織TNF-α表達,結果顯示復發組TNF-α表達水平高于未復發組。B.隨著腫瘤周圍組織中 TNF-α 表達的增加,肝門區的 p-STAT3 表達增加。
五,高TNF-α表達影響肝癌靶向藥療效
體外實驗表明TNF-α通過誘導上皮-間質轉化(EMT)促進肝癌細胞對索拉非尼耐藥。且目前的研究表明索拉非尼對 TNF-α 的表達和分泌沒有顯著影響,無法逆轉高 TNF-α 表達對于HCC 細胞中EMT誘導作用。
一項納入 62 例HCC患者術后介紹索拉非尼輔助治療的研究中分析了 TNF-α表達與預后的相關性。研究發現高 TNF-α表達的HCC患者無復發生存期及總生存期均較低TNF-α表達的HCC患者更短[25]。
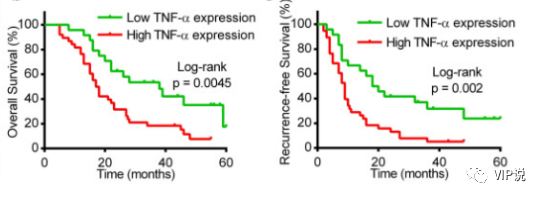
圖4:Kaplan-Meier 分析表明具有較低 TNF-α表達的 HCC 患者總生存期和無復發生存期均較差(n=62)
六,淫羊藿素軟膠囊可降低TNF-α表達
淫羊藿素軟膠囊為傳統中藥材提取的黃酮類化合物,是擁有全球自主知識產權的1.2類中藥創新藥,是一種新型的小分子免疫調節劑。它獨特的雙通道免疫調節機制可以:1.通過抑制JAK2和STAT3磷酸化抑制IL-6/JAK2/STAT3信號通路,下調IL-6及TNF-α水平;2.通過直接結合MyD88/IKKα,抑制TLR- MyD88-IKK-NFκB信號通路,從而減少TNF-α、IL-6等因子產生,進一步下調IL-6/JAK2/STAT3信號通路,兩條通路相輔相成,通過調節體內促炎性因子水平來調節腫瘤免疫微環境。而TNF-a 與 IFN-γ是作為綜合生物標志物評分(CBS,composite biomarker score)中的兩個細胞因子,也和其他標志物共同參與到阿可拉定 II-III 期臨床研究中的 HCC 療效預測部分。
研究表明,在富集人群中(滿足以下檢測指標的至少兩項:①AFP ≥ 400ng/mL ②TNF-α<2.5 pg/mL ③IFN-γ ≥ 7.0pg/mL。),淫羊藿素組的中位總生存期為13.54個月,Harzard ratio為 0.43,死亡風險比對照組降低57%。獨立影像學評估的試驗組患者中位至疾病進展中位時間也比對照組延長了近一倍,為3.65個月,中位無進展生存期為2.79個月。且不良反應發生率極低,3級以上總不良反應發生率不到10%。根據該III其研究結果,淫羊藿素軟膠囊被2022版CSCO肝癌診療指南推薦用于晚期肝癌的治療(1B類證據),且對于肝功能較差的患者中獲得了CSCO指南的Ⅰ級推薦(1B類證據)。
七,逐典腫瘤壞死因子alpha(TNF-α)特點:
1.高純度;2.高特異性;3.無動物源(AOF);4.GMP級別;5.無His標簽
實驗數據:
SDS-PAGE鑒定和SEC-HPLC純度:還原的SDS-PAGE 未見雜蛋白(左);SEC-HPLC顯示高純度大于 98%,無聚集體產生(右)
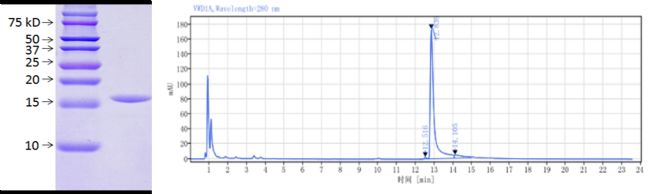
SDS-PAGE鑒定和SEC-HPLC純度圖
應用案例:
TNF-α活性:
在放線菌素D存在下通過鼠L929細胞的細胞溶解測定的ED 50 ≤ 0.05 ng/ml,對應比活性≥ 2 x 10 7units/mg。
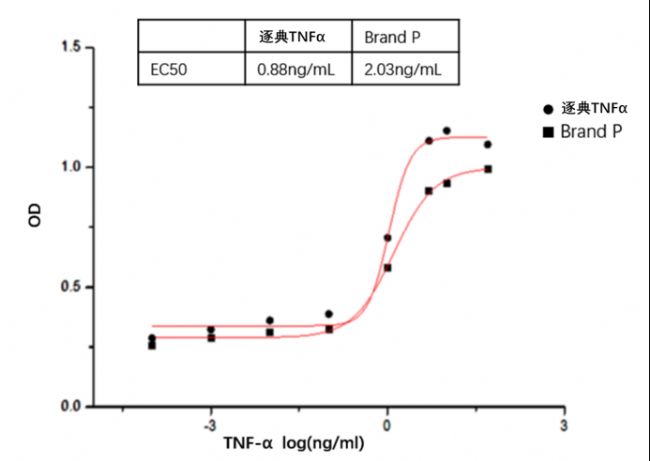 TNF-α濃度與鼠L929細胞OD關系
TNF-α濃度與鼠L929細胞OD關系




