熒光素酶報告原理及其在基因的啟動子和轉錄因子調控研究中的應用
盡管有些腫瘤或疾病確實是由于基因組本身遺傳信息改變所致,但是表觀調控有時能更好地闡述腫瘤或疾病發生的機制。在課題進展中,尤其是在確定表型之后,我們往往從表觀調控,或轉錄調控,或蛋白修飾的方向去研究表型發生的機制。差異基因與表型間的關系往往是比較容易確定的,機制的挖掘則相對復雜!全基因組篩選是表觀調控的一種策略,通過生信分析來挖掘關鍵基因也是一種策略。
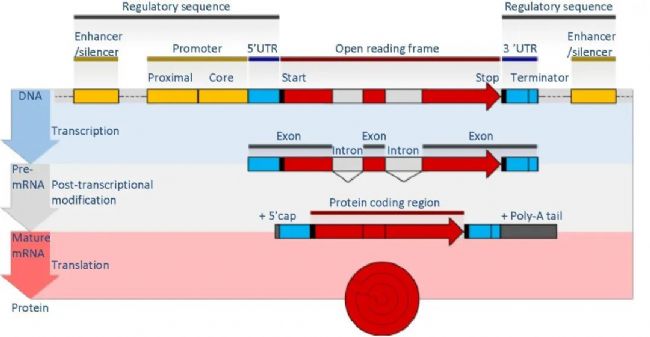
一個完整的基因結構包括諸多要素,比如編碼區,包括外顯子與內含子;前導區,位于編碼區上游,相當于RNA5'末端非編碼區,含有調控區,包括啟動子和增強子等;尾部區,位于RNA3'編碼區下游,相當于末端非編碼區。基因編碼區兩側也稱側翼順序。前導區可調控基因表達,被定義為順式作用元件,包括啟動子、增強子、調控序列和可誘導元件等。順式作用元件本身不編碼任何蛋白,僅僅提供與反式作用因子相互作用位點。本質是核苷酸序列,即DNA片段。

反式作用因子與特異的順式作用元件結合,參與基因表達調控的因子。編碼反式作用因子的基因與被反式作用因子調控的基因不在同一染色體上。反式作用因子有兩個重要的功能結構域:DNA結合結構域和轉錄活化結構域,這是反式作用因子發揮轉錄調控功能的必需結構。反式作用因子可被誘導合成,其活性也受多種因素的調節。這里的反式作用因子本質上是蛋白。轉錄因子是反式作用因子的重要組成,可被誘導表達。

轉錄因子的DNA結合域和順式作用元件實現共價結合,從而對基因的表達起抑制或增強的調控作用。熒光素酶報告基因系統(Luciferase reporter)就是檢測轉錄因子與目的基因啟動子區DNA相互作用的一種檢測方法。原理就是把啟動子序列克隆到Firefly luciferase之前,用感興趣的啟動子去啟動Firefly luciferase的表達。如下圖,想要研究IFNa或者IFNβ的表達調控,就把IFNa或者IFNβ的啟動子克隆到Firefly luciferase之前,內參就是用TK基因的啟動子啟動Renilla luciferase的表達。
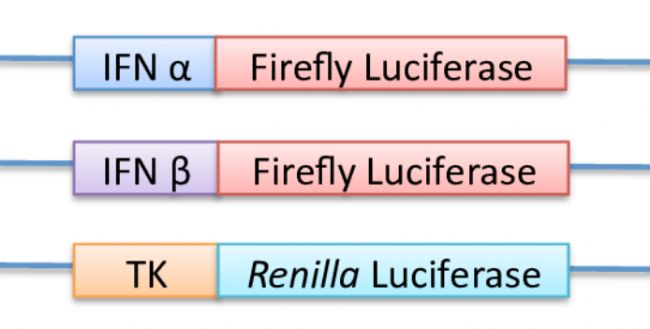
熒光素酶報告原理(Rachael Kenworthy et al. 2009. Nucleic Acids Res)
如果我們想要研究某個轉錄因子是否能與某一靶啟動子片段有作用。首先將靶基因啟動子或其他待研究基因調控元件插入到熒光素酶報告基因前方,構建成報告基因質粒。然后,將可以表達待檢測轉錄因子質粒與報告基因質粒共轉染細胞;如果此轉錄因子能夠激活靶啟動子,則熒光素酶基因就會表達,熒光素酶的表達量與轉錄因子的作用強度成正比;再加入特定熒光素酶底物,熒光素酶與底物反應,產生熒光。通過檢測熒光的強度可以測定熒光素酶的活性,從而判斷轉錄因子是否能與此靶啟動子片段有作用。

同時,為了減少細胞數目,細胞轉染和裂解效率等內在因素對實驗準確性的影響,將帶有海腎熒光素酶基因 (Renilla luciferase的質粒pRL-TK作為對照質粒與報告基因質粒共轉染細胞,提供轉錄活力的內參對照,使測試結果不受實驗條件變化干擾。在測量過程中,當加入熒光素酶檢測試劑Ⅱ時產生螢火蟲熒光信號,這樣先測量螢火蟲熒光素酶報告基因。定量螢火蟲熒光強度之后,再在同一樣品中加入反應試劑,將上述反應淬滅,并同時啟動海腎熒光素酶反應,同時進行第二次測量。那么,怎么用熒光素酶報告系統研究基因的啟動子和轉錄因子調控呢?

2023年8月,國際知名學術期刊J Hematol Oncol發表一篇題為Synergistic efficacy of simultaneous anti-TGF-β/VEGF bispecific antibody and PD-1 blockade in cancer therapy的研究論文,其中使用Luciferase reporter體系檢測TGF-β/VEGF雙特異性抗體對TGF-β信號的阻斷效果。

實驗操作:96孔板中接種30000的A549或MDA-MB-231細胞,37℃過夜培養。第二天,每孔轉染0.2μg SBE4 luciferase reporter質粒。24小時后,分別用10 ng/ml TGF-β1和106 pM的特異性抗體Y332D處理24小時;然后進行熒光報告檢測。
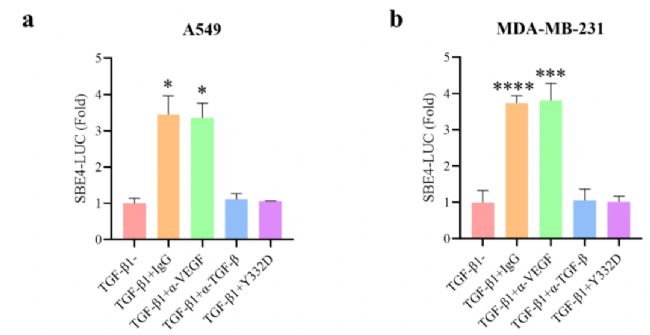
結果和結論:Research revealed that TGF-β mediates the transcription of Smad-Binding Element-containing luciferase reporter construct, SBE4-Luc. Therefore, SBE4 luciferase reporter assay was performed to test the blocking capability of Y332D on TGF-β/Smad pathway. The results showed that Y332D remarkedly blocked TGF-β1 signaling in A549 and MDA-MB-231 cells. Also, Y332D significantly antagonized TGF-β1-regulated EMT in A549 and MDA-MB-231 cells.





