FB23-2和放線菌素D助力揭秘IRF8在淋巴細胞白血病中的作用機制
AbMole以其卓越的品質、與時俱進的產品、專業無憂的服務,不斷鼎力支持全球科學家獲得重要的突破性成果。
由來自山東大學齊魯醫學院的 Ying Zhou,JingJing Ye以及ChunYan Ji等多名研究人員在期刊Adv Sci (Weinh)(IF=15.1)上,共同發表了題為“Silencing of IRF8 Mediated by m6A Modification Promotes the Progression of T-Cell Acute Lymphoblastic Leukemia”的文章。在該文章中,研究人員使用了購自AbMole的FB23-2(M9422)和 Actinomycin D(M4881)兩種產品,揭示了IRF8在T細胞急性淋巴細胞白血病(T-ALL)中的抑制作用,并闡明FTO通過調控IRF8的m6A甲基化修飾,從而介導T-ALL發病的具體機制,為T-ALL的研究提供了極具潛力的新策略。

T-ALL是一種侵襲性血液惡性腫瘤,并且預后較差。因此探究T-ALL的發生發展機制,尋找新的研究靶點,對攻克T-ALL具有重要的科學價值。
研究人員通過比較T-ALL患病受試者以及健康人之間的差異表達基因(DEGs),發現IRF8在T-ALL患病受試者中受到異常抑制(圖1A-B)。然后通過慢病毒轉染,在T-ALL細胞系Molt4和Jurkat中過表達IRF8,并進行CCK8和EdU檢測等實驗,發現上調IRF8能顯著抑制T-ALL細胞的生長(圖1C)以及侵襲遷移能力(圖1D-E)。
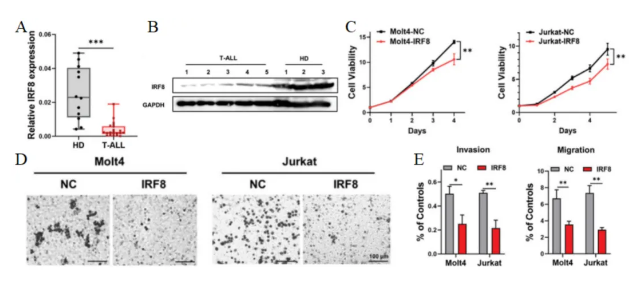
圖 1 A. 通過qRT-PCR檢測新診斷的T-ALL患病受試者和健康供體骨髓中IRF8的表達。B. 通過免疫印跡法檢測新診斷的T-ALL患病受試者和健康供體骨髓中IRF8的表達。C. 通過CCK8試驗分析IRF8表達的Molt4細胞、Jurkat細胞和NCs的增殖情況。D. 過表達IRF8的Molt4和Jurkat細胞,以及NC細胞在Matrigel基質膜下的結晶紫染色。E. 過表達IRF8的Molt4細胞和NC的侵襲和遷移能力。
接下來,研究人員通過構建Irf8敲除小鼠進行實驗(圖2A),結果顯示,Irf8-/-組小鼠的T-ALL發展具有高侵襲性,并且潛伏期更短,同時表現出明顯的肝脾腫大和股骨蒼白,說明存在白細胞增多、紅細胞減少和多器官浸潤等情況(圖2B)。此外,基因敲除小鼠骨髓GFP+細胞中Ki67水平升高,表明敲除Irf8能促進白血病細胞的增殖(圖2C),提示Irf8的缺失能與驅動基因協同作用,共同加速T-ALL發展。
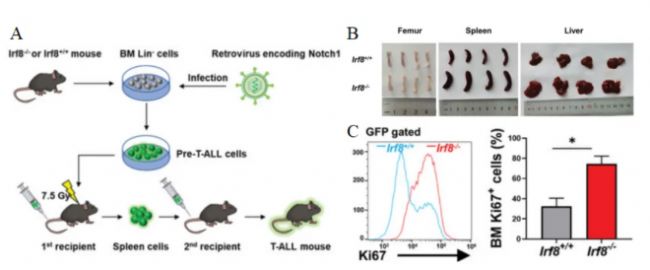
圖 2 A. 建立T-ALL小鼠模型的程序。B. 移植了Irf8-/-和Irf8+/+脾細胞的小鼠在移植后兩周時的股骨、脾臟和肝臟圖像。C. 移植兩周后,Irf8-/-組和Irf8+/+組GFP+門控骨髓細胞的Ki67表達情況。
KEGG對DEGs的分析顯示,PI3K/AKT信號通路顯著富集(圖3A)。隨后選擇PI3K/AKT信號相關DEGs—PIK3R5(圖3B)進行進一步研究。免疫印跡(圖3C)和CCK8(圖3D)結果顯示,在IRF8過表達的Molt4細胞中,PIK3R5表達下調,AKT和mTOR的磷酸化水平降低。表明在T-ALL中,IRF8通過PIK3R5負調控PI3K/AKT通路。
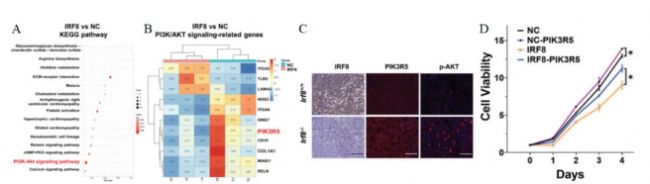
圖 3 A. KEGG分析顯示,與陰性對照(NC)Molt4細胞相比,RNA-seq檢測到IRF8表達的Molt4細胞中PI3K/AKT通路富集。B. 熱圖顯示了IRF8表達的Molt4細胞(E1、F1、G1)和陰性對照(NC)Molt4細胞(E2、F2、G2)中與PI3K/AKT信號相關的DEGs。PIK3R5被確定為DEG。C. Irf8-/-和Irf8+/+ T-ALL小鼠脾臟中IRF8、PIK3R5和p-AKT表達的免疫熒光結果。D. PIK3R5過表達對Molt4-NC和Molt4-IRF8細胞活力的影響。
之后,研究人員使用Jaspar數據庫,在PIK3R5的啟動子區域發現IRF8的潛在結合位點(圖4A)。染色質免疫沉淀(ChIP)顯示,IRF8免疫沉淀中的PIK3R5啟動子序列顯著富集(圖4B),表明IRF8可直接識別PIK3R5啟動子序列中的結合基序,調控PIK3R5轉錄。

圖 4 A. Jaspar數據庫預測的PIK3R5啟動子區域中可與IRF8結合的潛在基團。B. Molt4細胞中PIK3R5的ChIP‐qPCR分析和相應的電泳圖譜。
隨后,研究人員對T-ALL數據集GSE13159進行基因組富集分析(GSEA),結果顯示T-ALL患病受試者體內各種m6A調控因子發生顯著變化,其中以FTO的變化水平最為明顯(圖5A)。Pearson相關分析表明,在兩個獨立的T-ALL群體中,FTO和IRF8的表達存在明顯的負相關性(圖5B)。
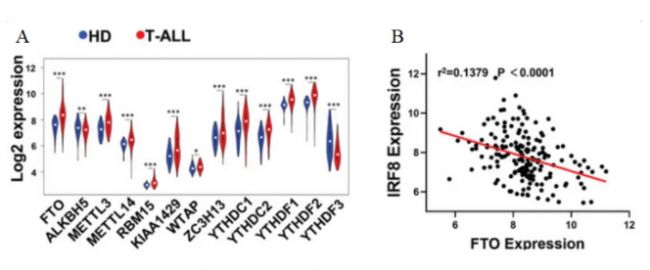
圖 5 A. T-ALL患病受試者和健康供體(HDs)骨髓中m6A調節因子的Log2表達值。B. 來自GSE13159的174份T-ALL樣本中FTO和IRF8表達水平的相關性,Pearson相關性分析。
接下來,用小發夾RNA(shRNA)慢病毒敲除FTO或使用FB23-2抑制FTO水平進行實驗,檢測發現,兩種方式均會導致IRF8表達水平升高(圖6A-B),證明IRF8的表達受到FTO介導的m6A修飾的負調控。
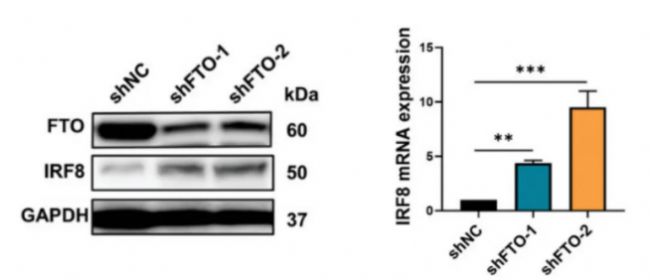
圖 6 A. 通過Western印跡檢測轉染FTO shRNA慢病毒(shFTO-1和shFTO-2)或陰性對照(shNC)的Molt4細胞中FTO和IRF8的水平。B. 轉染shFTO-1、shFTO-2或shNC慢病毒的Molt4細胞中IRF8 mRNA水平的qRT-PCR分析。
隨后,研究人員使用FB23-2處理Molt4細胞,發現m6A的總體豐度提高(圖7A),且IRF8的表達提高2至3倍(圖7B)。MeRIP-seq分析顯示,FTO失活導致IRF8 3′非翻譯區(UTR)的m6A水平明顯增加。此外,FTO RIP-seq分析顯示,FTO結合峰富集在IRF8 mRNA轉錄本中,IRF8轉錄本3′UTR中的軌跡與m6A峰重疊(圖7C)。
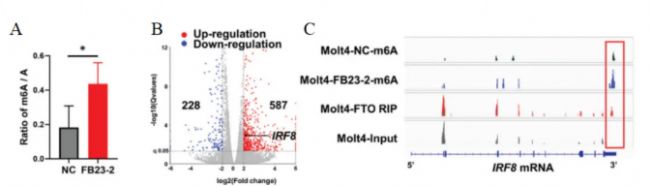
圖 7 A. 用2 µm FB23-2或DMSO(NC)培養48小時的Molt4細胞中mRNA的總體m6A豐度,并用LC-MS/MS描述m6A/A的比率。B. DEGs的火山圖;IRF8用黑點標出。藍點:下調基因;紅點:上調基因。C. Integrative Genomics Viewer (IGV)追蹤描繪用DMSO載體或FB23-2處理的Molt4細胞中IRF8基因的m6A修飾,以及IRF8基因座中的FTO RIP-seq信號和相應的輸入信號。
之后設計引物擴增IRF8 3′UTR中包含預測的潛在結合位點的序列(圖8A),并進行RIP-qPCR檢測,共篩選出五個可能被FTO直接結合的潛在m6A位點(圖8B)。隨后,將候選m6A位點從A到T分別替換(MUT1至MUT5,圖8C),并構建野生型和五個突變型IRF8 3′UTR報告載體。經研究發現,轉染WT報告載體細胞的熒光素酶活性明顯高于HEK293T-shNC細胞。并且轉染MUT1至MUT5報告載體后,可以恢復熒光素酶活性(圖8D)。表明IRF8是FTO的一個關鍵靶點,FTO通過這些m6A位點負調控IRF8 mRNA的表達。隨后,研究人員使用FB23-2和Actinomycin D處理Molt4和Jurkat細胞,發現IRF8轉錄本的半衰期明顯延長(圖8E)。表明抑制FTO的去甲基化活性可通過促進RNA穩定性和減少RNA降解來恢復IRF8 mRNA的表達。
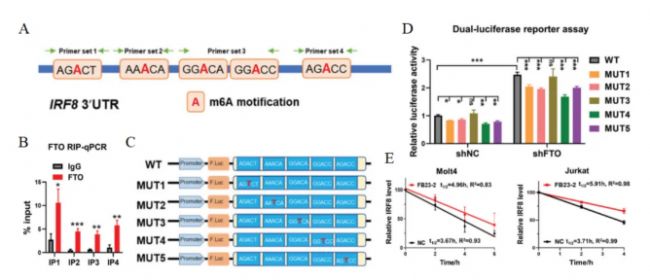
圖 8 A. IRF8 3′ UTR中潛在的m6A結合位點(位點1-5)示意圖。引物組3(IP3)包括兩個位點:位點3和位點4。B. FTO RIP-qPCR分析顯示FTO與Molt4細胞中IRF8 mRNA轉錄本結合。C. 克隆到pMIR-REPORT熒光素酶載體的IRF8 mRNA 3′ UTR野生型(WT)以及m6A識別位點從A核苷酸突變為T核苷酸的五個突變序列(MUT1至MUT5)示意圖。D. 野生型IRF8 mRNA 3′ UTR(WT)和突變型IRF8 mRNA 3′ UTR(MUT1至MUT5)報告載體轉染有或無FTO敲除的HEK293T細胞的相對熒光素酶活性。E. 用5 µm FB23-2或DMSO(NC)預處理Molt4和Jurkat細胞24小時,并在指定時間用5 µg/mL Actinomycin D培養的IRF8 mRNA降解檢測,并與0小時的mRNA水平歸一化。
最后研究人員使用FB23-2處理Irf8+/+組和Irf8-/-組的T-ALL小鼠模型(圖9),并通過進行流式細胞術,點印跡檢測以及免疫印跡等分析。結果表明,抑制FTO的m6A去甲基化酶活性,能恢復T-ALL中IRF8的表達,從而通過PI3K/AKT信號轉導抑制T-ALL的發生。

圖 9 建立Irf8-/-和Irf8+/+ T-ALL小鼠模型及FB23-2給藥時間表(FB23-2:2 mg/kg)。
該研究使用了購自AbMole的FB23-2(M9422)和 ActinomycinD(M4881)兩種產品,FB23-2是一種新型FTO小分子抑制劑,可直接與FTO結合,選擇性地抑制m6A去甲基化酶的活性,在外顯子RNA甲基化靶向研究領域具有巨大的潛力和優勢。在該實驗中,研究人員多次使用FB23-2抑制FTO活性,進而更好的研究FTO與IRF8表達之間的調控機制。Actinomycin D是一種轉錄抑制劑,在該實驗中用于在 mRNA降解分析實驗中抑制轉錄,避免新轉錄的mRNA影響實驗結果。
研究人員使用FB23-2抑制FTO的活性,發現IRF8的表達水平升高,細胞增殖受到FB23-2劑量依賴性抑制(圖10A-B),并可以通過敲除IRF8得到有效緩解。進一步研究發現,FB23-2處理和IRF8敲除之間在細胞活力(圖10C)和集落形成活性(圖10D)方面具有明顯的交互作用,說明IRF8的表達受到FTO介導的m6A修飾的負調控。
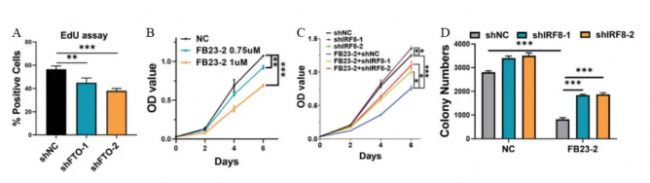
圖 10 A. 用不同濃度的FB23-2或DMSO(NC)處理Molt4細胞48小時的IRF8 mRNA水平。B. 用不同濃度的FB23-2或DMSO(NC)處理的Molt4細胞的增殖情況。C. 用shIRF8-1、shIRF8-2或shNC慢病毒轉染的Molt4細胞經FB23-2處理后的活力。D. 轉染shIRF8-1、shIRF8-2或shNC慢病毒并經1 µm FB23-2處理的Molt4細胞的集落形成能力。
此外,研究人員通過對Irf8+/+組和Irf8-/-組的T-ALL小鼠進行FB23-2處理(圖9)。流式細胞術顯示,給藥FB23-2能顯著降低Irf8+/+組骨髓、血液和脾臟中GFP+細胞的比例,以及Ki67的水平(圖11A),并且小鼠的存活時間延長(圖11B)。說明FB23-2能有效減輕Irf8+/+T-ALL小鼠的白血病負擔并延長其生存期。免疫印跡和免疫熒光分析表明,FB23-2能顯著增加Irf8+/+組小鼠骨髓和脾臟白血病細胞中IRF8的表達,并抑制PIK3R5的表達和AKT的磷酸化(圖11C-D)。因此,研究人員認為FB23-2抑制FTO的m6A去甲基化酶活性,能成功恢復T-ALL中IRF8的表達,并能通過抑制PI3K/AKT信號轉導,從而抑制白血病的發生過程。
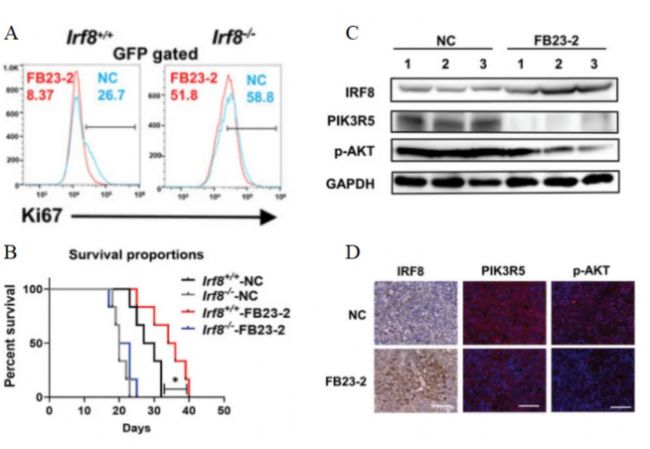
圖 11 A. 流式細胞儀測定的GFP+門控骨髓細胞的Ki67表達水平。B. 用FB23-2或DMSO(NC)處理的Irf8-/-組和Irf8+/+組小鼠的存活率。C. 免疫印跡分析FB23-2或DMSO(NC)處理的Irf8+/+T-ALL小鼠骨髓中的IRF8、PIK3R5和p-AKT水平。D. 給藥FB23-2或DMSO(NC)后Irf8+/+T-ALL小鼠脾臟中IRF8、PIK3R5和p-AKT表達的免疫熒光圖片。
總之,該研究揭示了一種新的T-ALL基因調控機制,并為T-ALL的遺傳機制和靶向研究提供了新的視角。
敬請關注:www.abmole.cn





