JHEP Reports文獻解讀:脾臟B細胞在自身免疫性肝炎中發揮致病作用
自身免疫性肝炎(AIH)是一種免疫介導的慢性肝病,由免疫系統攻擊肝細胞引起,其特點是血清轉氨酶水平升高、IgG水平升高和界面性肝炎。之前的研究發現,基于利妥昔單抗(CD20抗體)的B細胞清除療法是一種有效策略,適用于對標準療法無應答的患者。
這種疾病由T細胞介導,其中抗原激活的CD4+和CD8+ T細胞作為效應細胞分化和增殖。B細胞也被認為參與了自身免疫,具體途徑是抗原呈遞、產生自身抗體和細胞因子。然而,確切的分子機制至今仍未闡明,這可能是因為缺乏合適的AIH模型。
日本慶應義塾大學醫學院的研究人員近日利用腺相關病毒(AAV)IL-12模型,再現了自身反應性B細胞相關的AIH病理學的重要特征。他們成功鑒定了脾臟B細胞與細胞毒性CD8+ T細胞之間的相互作用。這項研究成果發表在《JHEP Reports》雜志上。
研究材料與方法
在這項研究中,研究人員在賽業生物的協助下構建了實驗性AIH模型,通過AAV載體在肝臟中過表達IL-12觸發細胞毒性T細胞的擴增,重現AIH患者的臨床特征。他們利用CD20抗體和B細胞過繼轉移驗證了脾臟B細胞的致病作用,并通過RNA測序分析發現了IL-15的表達上調。他們還通過流式細胞術等分析確認了脾臟B細胞與細胞毒性T細胞之間的相互作用。
技術路線
01 構建實驗性AIH模型,利用CD20抗體和過繼轉移分析脾臟B細胞的作用
02 通過RNA測序分析發現B細胞中的IL-15表達上調,并驗證肝炎發展是否依賴于IL-15
03 分析脾臟B細胞與CD8+ T細胞之間的相互作用及背后的分子機制
04 利用AIH患者的樣本驗證以上結果,以探索其轉化潛力
研究結果
1 實驗性AIH模型的構建
研究人員構建了pAAV IL-12質粒載體,并進行了AAV病毒包裝,然后他們將AAV IL-12注射到小鼠體內,并觀察給藥1-8周后的病理變化,以確定實驗性AIH(eAIH)模型的適當終點(其中AAV病毒包裝服務由賽業生物提供)。他們在4周內觀察到血清谷丙轉氨酶(ALT)、IgG、抗核抗體水平升高以及界面性肝炎增加,且ALT和AST(谷草轉氨酶)在4周時達到峰值。因此,他們在第4周開展了病理學分析,發現小鼠肝臟和脾臟中CD4+ T細胞和CD8+ T細胞的數量增加,其他特征也與AIH患者一致。這些結果表明,AAV IL-12模型適用于探索AIH病理學中的相關機制。
2 B細胞通過擴增CD8+ T細胞加重了eAIH
以往的研究顯示,利用CD20抗體清除B細胞對難治性AIH患者有效果。于是,研究人員也在AAV IL-12模型中研究了CD20抗體對肝炎的療效。CD20抗體治療導致肝臟和脾臟中的B細胞減少,肝炎在部分程度上改善。值得注意的是,他們觀察到血清IgG水平下降。CD20抗體治療降低了記憶性T細胞的數量,但不影響肝髓系細胞的數量。這些結果表明,B細胞在肝炎的發展過程中起著致病作用。
由于脾臟中的B細胞豐度很高,研究人員推測該器官中的B細胞尤其具有致病作用。為了弄清這一點,他們從注射了AAV IL-12的小鼠脾臟中分離出B細胞,將其過繼轉移至脾切除小鼠體內(圖1)。雖然脾切除術降低了ALT水平,但致病性B細胞的過繼轉移會逆轉這種改善。肝組織學和肝顆粒酶B+CD8+ T細胞的數量表現出類似的趨勢,而肝CD4+ T細胞的數量沒有變化。由此可見,脾臟B細胞通過擴增CD8+ T細胞(CTL)在肝炎的發展過程中發揮作用。
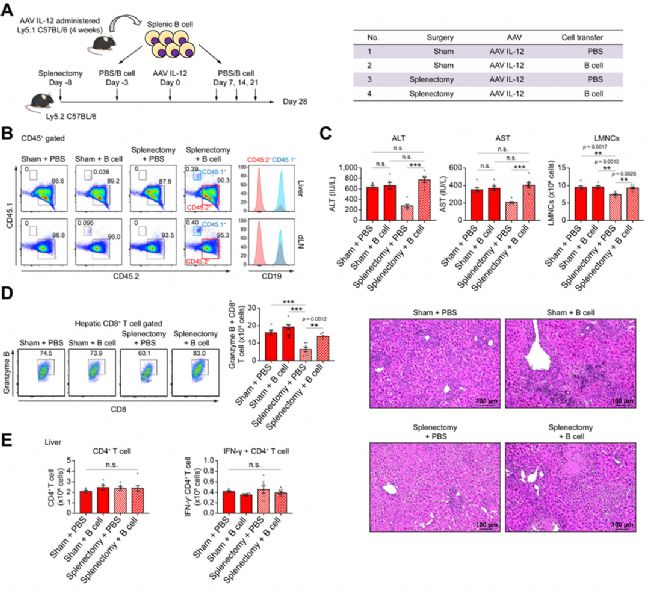
圖1 致病性B細胞的過繼轉移加重了脾切除小鼠的肝炎[1]
3 致病性B細胞中的IL-15表達增加
之后,通過RNA測序分析,研究人員發現致病性B細胞中IL-15的表達顯著上調。IL-15是一種眾所周知的細胞因子,促進記憶性CD8+ T細胞和CTL的維持和增殖。因此,他們推測B細胞來源的IL-15在誘導CTL及eAIH的后續發展中起關鍵作用。在小鼠脾臟中,B細胞大約占表達IL-15的免疫細胞的55%。在eAIH小鼠的肝臟/脾臟CD4+和CD8+ T細胞中,IL-15受體的表達升高,表明對IL-15信號傳導更加敏感。此外,他們還觀察到,eAIH小鼠脾臟中的B220+ B細胞和CD8+ T細胞彼此相鄰,這表明它們之間存在直接的相互作用。
為了驗證CTL增殖和肝炎發展是否依賴于IL-15,他們通過體內實驗研究了IL-15中和的效果。與預期一致,在注射IL-15抗體后,小鼠的血清ALT水平顯著降低,脾細胞數量減少,而肝臟單核細胞(LMNC)不受影響,表明IL-15抗體對脾臟的作用更強。同樣地,脾臟和肝臟中的總CD8+ T細胞和顆粒酶B+ CD8+ T細胞數量也減少,表明IL-15中和可抑制脾臟和肝臟CTL,從而改善肝炎。
4 IL-15+ B細胞與CD40L+CD8+ T細胞相互作用
為了驗證B細胞與CD8+ T細胞之間的相互作用,研究人員將來自eAIH小鼠的脾臟CD8+ T細胞與分離自eAIH或對照小鼠的脾臟B細胞進行共培養。他們發現,與致病性B細胞的共培養可誘導CD44+CD8+ T細胞的增殖,而對照B細胞則不能(圖2)。值得注意的是,IL-15的中和抑制了CD44+CD8+ T細胞的增殖。這些結果表明,來源于脾臟B細胞的IL-15促進了記憶性CD8+ T細胞的增殖和維持。
那么,B細胞中的IL-15是如何上調的?后續的分析發現,IFN-γ和CD40抗體的聯合刺激可上調小鼠脾臟B細胞中Il15、Cxcl10和Csf1的基因表達,這表明CD40L+細胞在誘導IL-15+ B細胞的過程中發揮重要作用(圖2)。流式分析表明,eAIH中的脾臟CD8+ T細胞表現出CD40L表達上調。這些結果共同表明,脾臟IL-15+ B細胞和CD40L+ CD8+ T細胞相互作用以獲得病理功能。
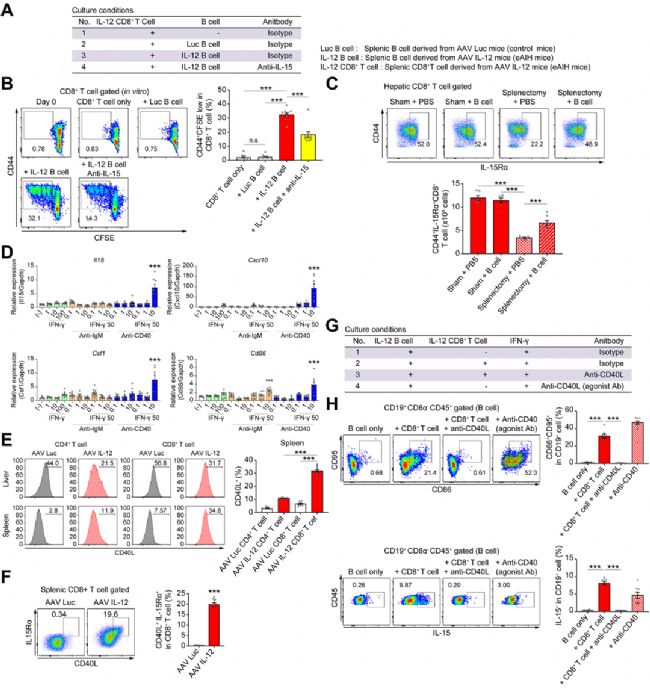
圖2 IL-15+ B細胞與CD40L+CD8+ T細胞相互作用[1]
研究人員假設,記憶性CD8+ T細胞和CTL在脾臟B細胞誘導下增殖,隨后遷移到肝臟造成肝細胞損傷。他們發現,在發炎肝臟的CD8+ T細胞中,趨化因子受體CXCR3的表達明顯增加。CXCR3配體在肝臟中的基因表達也增加,其中Cxcl9的上調最為顯著。CXCL9的中和可改善eAIH。CXCL9抗體治療明顯降低了肝臟顆粒酶B+ CD8+ T細胞和IL-15Ra+ CXCR3+ CD8+ T細胞的數量,表明CXCL9/CXCR3軸在肝炎發展中起著關鍵作用。
5 AIH患者血液中的IL-15+ B細胞增加
最后,為了探索這些結果的轉化潛力,研究人員還分析了患者的臨床樣本。他們發現,AIH患者血清中存在高濃度的IL-15和IL-15+ B細胞,并與ALT水平呈正相關。此外,他們還觀察到CD40L+IL-15Ra+記憶性T細胞的誘導,表明在AIH患者中存在與IL-15+ B細胞的相互作用。這些結果支持在AIH患者中進行轉化研究和靶向治療。
研究結論

圖3 脾臟IL-15+ B細胞在AIH發展中發揮致病作用[1]
這項研究利用實驗性AIH模型再現了人類AIH的臨床特征。通過這個模型,他們發現IL-15和CD40L對脾臟中B細胞與CD8+ T細胞之間的相互作用是不可缺少的,這種互作導致CD8+ T細胞局部擴增,并通過CXCL9/CXCR3軸遷移到肝臟,導致AIH發生。體外和體內分析證實了B細胞在AIH中的致病作用(圖3)。研究人員認為,對致病性B細胞的進一步研究有望催生CD20抗體治療之外的新型治療方法。
參考文獻:
[1]Fujimori S, Chu PS, Teratani T, et al. IL-15-producing splenic B cells play pathogenic roles in the development of autoimmune hepatitis. JHEP Rep. 2023 Apr 7;5(7):100757. https://doi.org/10.1016/j.jhepr.2023.100757






