CAR-T和CAR-NK作為實體瘤細胞癌免疫療法的應用優勢及局限性
以下文章來源于Of Studies ,作者Of studies
在過去的十年中,嵌合抗原受體T細胞療法已成為抗擊癌癥的一種極有前景的免疫治療方法,對兒童和成人的復發/難治性血液系統惡性腫瘤表現出顯著的療效。CAR自然殺傷(CAR-NK)細胞補充了CAR-T細胞療法,提供了幾個獨特的優勢。CAR-NK細胞不需要HLA兼容性,并且表現出較低的安全性問題。此外,CAR-NK細胞有利于“現貨”治療,有比CAR-T細胞更方便的物流優勢。CAR-T和CAR-NK細胞在血液系統惡性腫瘤中均顯示出一致和有希望的結果。
然而,對實體瘤的療效均受到諸多限制,原因包括有限的腫瘤遷移和浸潤,以及免疫抑制性腫瘤微環境。
這篇綜述討論了CAR-T和CAR-NK細胞免疫療法的最新進展和當前挑戰,特別關注它們在實體瘤應用中的障礙。并深入分析了CAR-NK細胞與CAR-T細胞相比的優勢和缺點,并強調了CAR-NK的CAR優化。
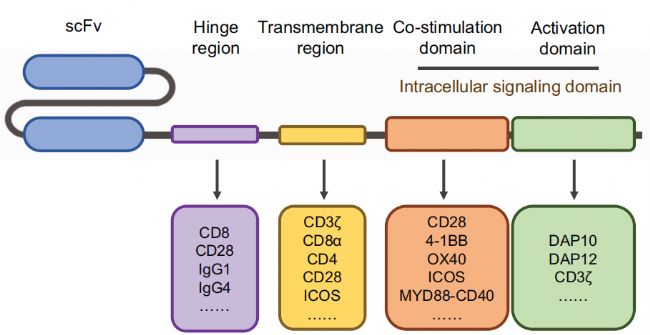
1、CAR的結構
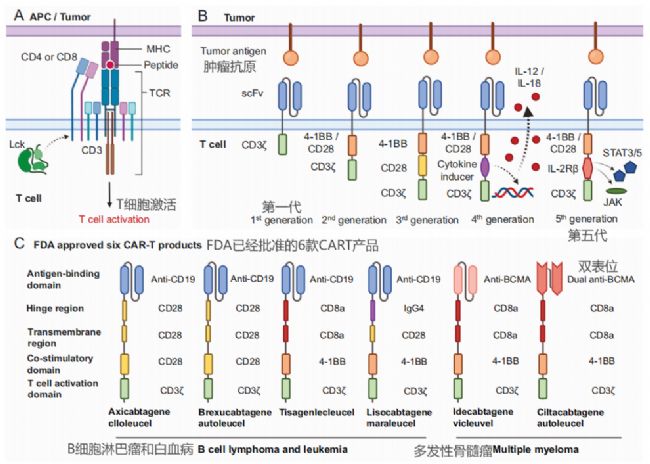
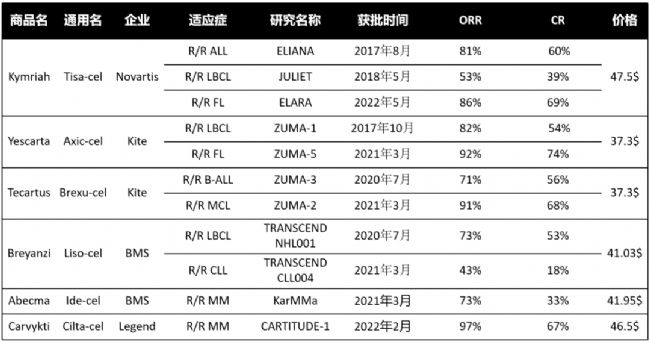
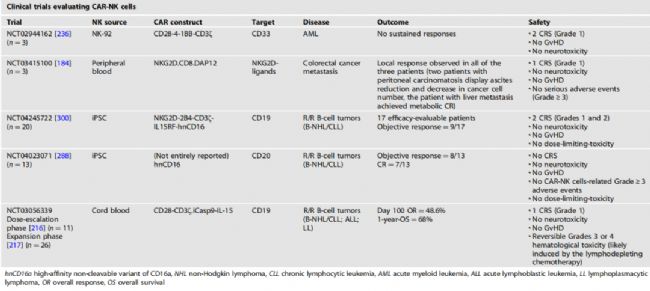
6款產品有效性如下
根據不同的設計理念和結構組成,CAR可以分為五代:
- 第一代CAR(1st generation CAR):主要由單鏈可變片段(scFv)構成的抗原結合域和CD3ζ鏈構成的T細胞激活域組成。這些CAR的設計相對簡單,能夠使T細胞識別特定的腫瘤抗原,并通過CD3ζ鏈直接激活T細胞。第一代CAR-T細胞在臨床試驗中顯示出有限的增殖、植入和細胞毒性,導致臨床效果不佳。
- 第二代CAR(2nd generation CAR):在第一代的基礎上增加了共刺激信號域,如4-1BB或CD28信號域,以增強T細胞的激活和增殖。這些共刺激信號域能夠提供額外的信號,從而改善CAR-T細胞的持久性和效力。
- 第三代CAR(3rd generation CAR):結合了第二代CAR的特點,同時包含4-1BB和CD28兩個共刺激信號域。這種設計旨在進一步增強CAR-T細胞的活性和功能,提高其對腫瘤細胞的殺傷能力。
- 第四代CAR(4th generation CAR):結合前三代特點,不僅能夠識別和殺死腫瘤細胞,還能分泌細胞因子,如IL-12,以增強局部的免疫反應。這種CAR設計旨在通過分泌細胞因子來激活和招募更多的免疫細胞參與抗腫瘤反應。
- 第五代CAR(5th generation CAR):第五代CAR-T細胞的設計更加復雜,可能包括多個細胞因子的共表達,或者結合了特定的免疫調節策略,如PD-1/PD-L1的阻斷。這些CAR-T細胞旨在通過多種機制增強T細胞的抗腫瘤活性,同時減少T細胞耗竭和提高T細胞在腫瘤微環境中的存活率。
每一代CAR的設計都旨在解決前一代CAR在臨床應用中遇到的問題,如持久性、療效和安全性等。隨著研究的深入和技術的進步,CAR-T和CAR-NK細胞療法正在不斷發展,以提高對癌癥的治療效果。
2、CAR-T面臨的挑戰和攻克實體瘤的工程策略
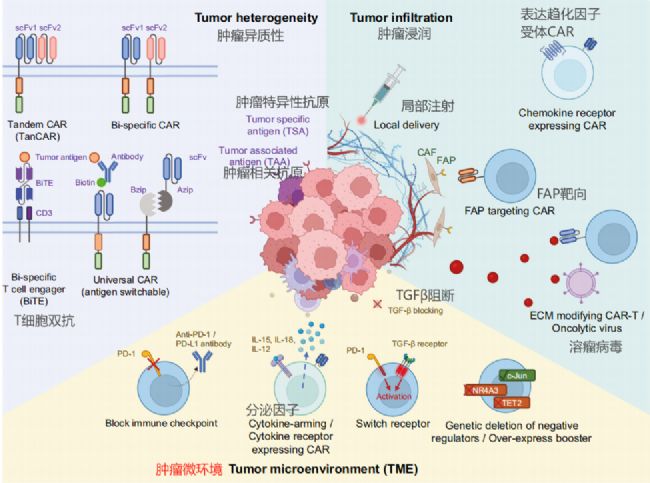
CAR-T細胞療法在治療實體瘤方面面臨多重挑戰,主要包括以下幾點:
1.腫瘤異質性(Tumor Heterogeneity):實體瘤內部存在高度的異質性,腫瘤細胞可能表達不同的抗原,使得單一靶向策略容易因抗原逃逸而失敗。
2.腫瘤浸潤和滲透(Tumor Infiltration):實體瘤的微環境,包括纖維化基質和異常血管,構成了物理屏障,阻礙CAR-T細胞的浸潤和滲透。
3.免疫抑制性腫瘤微環境(Immuno-Suppressive TME):實體瘤微環境中存在多種免疫抑制性細胞和因子,如調節性T細胞(Tregs)、骨髓源抑制細胞(MDSCs)以及免疫抑制配體和因子(如PD-L1、TGF-β和腺苷),這些因素抑制CAR-T細胞的活性、增殖和持久性。
為了克服這些挑戰,研究人員開發了多種工程策略:
1.多靶點靶向策略(Multi-Targeting Strategies):通過組合不同CAR-T細胞產品或開發能夠同時識別多個抗原的CAR-T細胞(如雙特異性CAR或TanCAR),來減少抗原逃逸現象。
2.增強CAR-T細胞的遷移和浸潤(Enhancing Trafficking and Infiltration):通過基因工程改造CAR-T細胞,使其表達特定的趨化因子受體,如CXCR4、CCR4或CCR2b,以增強其向腫瘤組織的遷移能力。
3.阻斷免疫檢查點(Blocking Immune Checkpoints):通過基因編輯或共給予免疫檢查點抑制劑(如抗PD-1/PD-L1抗體),來逆轉CAR-T細胞的功能障礙。
4.增強CAR-T細胞的抗腫瘤功能(Enhancing Anti-Tumor Function):通過共刺激信號域的優化、分泌刺激性細胞因子(如IL-12、IL-18或IL-15)或調節T細胞內源性遺傳調節因子,來增強CAR-T細胞的抗腫瘤活性。
5.提高臨床安全性(Improving Clinical Safety):通過引入“自殺基因”或開發可切換的CAR-T細胞,以減少細胞因子釋放綜合征(CRS)和神經毒性等嚴重副作用。
這些策略的發展和應用有望提高CAR-T細胞療法在實體瘤治療中的有效性和安全性。
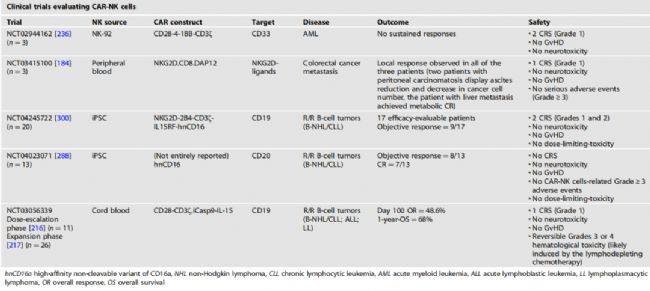
3、評價CAR-NK細胞療法的代表性臨床試驗
4、改善CAR-NK細胞治療實體瘤的當前挑戰和持續策略
A.細胞遷移(Cell Trafficking):CAR-NK細胞在有效靶向實體瘤時面臨的一個主要挑戰是細胞遷移能力。圖中可能展示了不同的策略,比如通過基因工程改造CAR-NK細胞以表達特定的趨化因子受體,增強其向腫瘤組織的遷移能力。
B.腫瘤微環境(Tumor Microenvironment, TME):實體瘤的微環境對NK細胞功能有抑制作用。圖中可能描述了如何通過藥理學抑制或基因工程手段來克服TME中的免疫抑制因素,例如通過抑制TGF-β或通過基因編輯減少免疫抑制細胞的影響。
C.NK細胞的持久性(NK Cell Persistence):NK細胞在體內的持久性較短,這對于CAR-NK細胞治療是一個挑戰。圖中展示了如何通過基因工程改造CAR-NK細胞,如使其表達IL-15等細胞因子,以增強其在體內的持久性和抗腫瘤活性。
D.CAR構建的優化(Optimizing CAR Constructs):展示了針對NK細胞信號傳導優化的CAR構建,包括不同的胞外scFv結構域、跨膜區和胞內共刺激域的選擇,以提高CAR-NK細胞的療效。
E.不同的NK細胞來源(Different Sources of NK Cells):討論了不同的NK細胞來源,包括NK-92細胞系、外周血、臍帶血、造血干細胞和誘導多能干細胞(iPSC),以及這些來源的優缺點。
F.增強CAR-NK細胞功能的替代策略(Alternative Strategies for Enhancing CAR-NK Cell Function):通過基因編輯技術增強NK細胞的抗腫瘤活性,例如通過CRISPR技術敲除特定的抑制基因或過表達增強NK細胞活性的基因。
5、CAR-NK結構設計與優化藍圖
6、CAR-T和CAR-NK細胞的優勢和局限性
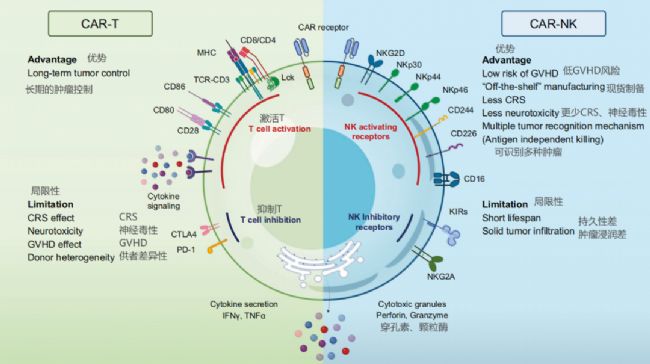
CAR-T細胞的優勢和局限性:
優勢:
- 長期腫瘤控制:CAR-T細胞能夠提供長期的腫瘤控制能力,因為它們可以長期存在于體內并持續對腫瘤細胞進行監控和攻擊。
- 個性化治療:CAR-T細胞通常來源于患者自身(自體)的T細胞,這意味著它們可以被設計為特異性識別患者腫瘤上的特定抗原。
- 強大的攻擊力:T細胞具有強大的攻擊力,能夠直接殺死腫瘤細胞。
局限性:
- 細胞因子釋放綜合征(CRS):CAR-T細胞治療可能引起CRS,這是一種可能危及生命的系統性炎癥反應。
- 神經毒性:一些CAR-T細胞治療與神經毒性相關,可能導致認知和神經系統的副作用。
- 移植物抗宿主病(GvHD):使用異體T細胞時,存在GvHD的風險,即移植的T細胞攻擊宿主組織。
- 制造過程復雜:CAR-T細胞的制造過程復雜、耗時且成本高,通常需要幾周時間。
- 腫瘤抗原逃逸:腫瘤可能通過改變或丟失CAR-T細胞靶向的抗原來逃避免疫攻擊。
優勢:
- 低風險GvHD:CAR-NK細胞不涉及T細胞受體(TCR),因此使用異體NK細胞時不會引起GvHD。
- “現成的”制造:CAR-NK細胞可以批量生產,提供“現成的”治療選項,這可能降低成本并加快治療進程。
- 減少CRS和神經毒性:與CAR-T細胞相比,CAR-NK細胞治療引起的CRS和神經毒性風險較低。
- 多種腫瘤識別機制:NK細胞可以通過多種機制識別和殺死腫瘤細胞,包括抗原依賴和抗原非依賴的方式。
局限性:
- 壽命短:NK細胞在體內的壽命較短,可能需要多次輸注以維持治療效果。
- 實體瘤浸潤能力有限:NK細胞可能難以有效地滲透和浸潤實體瘤,這限制了它們對腫瘤的攻擊能力。
- 抗腫瘤效果可能有限:由于NK細胞的殺傷機制與T細胞不同,它們對某些類型的腫瘤可能不如CAR-T細胞有效。
- 病毒轉導效率低:NK細胞對病毒轉導的抵抗力較強,這可能影響CAR-NK細胞的制造效率。
- 抗原特異性問題:與CAR-T細胞一樣,CAR-NK細胞也面臨腫瘤抗原逃逸的問題。
小結
FDA最近對獲批的CAR-T細胞產品發出了警告,因為在一小部分接受CAR-T治療的患者中觀察到了T細胞惡性腫瘤。盡管這類事件的總體發生率較低,但在6種獲批的CAR-T細胞療法中有5種產品反復報告了這種情況,導致FDA對這些療法增加了一類全面的警告標簽。
在這些病例中,有三例已經被證明癌細胞含有CAR,表明輸入治療的惡性轉化是關鍵原因。然而,這種惡性轉化似乎是一個罕見事件,鑒于目前CAR療法臨床指示的廣泛擴展,包括早期治療階段的癌癥和其他疾病,包括自身免疫疾病和HIV,對罕見不良事件的評估將變得更加重要。
生物技術發展與臨床試驗數據之間的動態而積極的交流是推動CAR-T和CAR-NK療法向下一代癌癥治療演進的關鍵,最終將帶來患者治療效果的改善。
參考文獻:Peng L, Sferruzza G, Yang L, Zhou L, Chen S. CAR-T and CAR-NK as cellular cancer immunotherapy for solid tumors. Cell Mol Immunol. 2024;21(10):1089-1108. doi:10.1038/s41423-024-01207-0.





