文獻解讀:糖尿病時單核細胞分泌pro-CTSD誘發血腦轉胞吞作用
2型糖尿病是全球范圍內日益嚴重的健康問題,血管并發癥是糖尿病致死和致殘的主要原因。關于糖尿病腦血管的研究,既往一直聚焦在頭頸大血管動脈硬化和血管狹窄方面。近年來隨著影像技術的發展糖尿病腦微血管病變逐漸受到關注。糖尿病微血管病變與中風、認知障礙、癡呆、抑郁、腦淀粉樣變以及脫髓鞘等多種疾病相關。關于腦微血管疾病的發病機制主要包括血腦屏障功能障礙、腦微血管血流調節減退以及炎癥因子誘發炎癥反應等,但2型糖尿病腦微血管病變的確切機制尚不明確。單核細胞是血液存在的最大的單個核白細胞,研究發現糖尿病模式小鼠循環血單核細胞明顯增加。并且發現糖尿病時單核細胞可以穿過血管內皮細胞到達血管壁下,在此分化為局部巨噬細胞并吞噬低密度脂蛋白形成泡沫細胞,這是糖尿病動脈粥樣硬化的核心病理生理過程。此外,還發現單核細胞可以通過信號調節影響血管發芽和血管生成等過程。然而,單核細胞與內皮相互作用是否參與以及如何參與糖尿病腦微血管病變至今仍不清楚。
趙偉東教授領導的課題組通過高通量測序發現,糖尿病患者循環血單核細胞組織蛋白酶D(CTSD)表達升高,并發現糖尿病微血管并發癥時單核細胞CTSD的表達水平進一步升高。由此,課題組構建了單核細胞表達人源CTSD的轉基因小鼠,并發現該小鼠出現了腦微血管通透性增加以及認知缺陷的表型,該表型與糖尿病微血管病變類似。機制方面,趙偉東教授課題組首次發現糖尿病時循環血單核細胞釋放非酶形式的pro-CTSD與腦血管內皮細胞表面低密度脂蛋白受體相關蛋白1(LRP1)相結合,上調小窩蛋白表達并激活腦血管內皮細胞中小窩蛋白介導的轉胞吞作用,進而導致腦微血管滲漏。在此過程中,血腦屏障經典的細胞旁通路并未參與。更重要的是,課題組發現單核細胞CTSD基因的敲除對糖尿病腦微血管滲漏和認知障礙具有保護作用,并由此提出了治療2型糖尿病腦微血管病變的新的治療策略。
該研究發表于美國心臟協會主辦的心腦血管基礎研究領域的國際期刊《循環研究》(Circulation Research,中科院一區,最新影響因子20.1),論文的第一作者是中國醫科大學附屬第一醫院神經外科趙丹,中國醫科大學生命科學學院趙偉東教授為該論文的通訊作者。第一作者單位為中國醫科大學附屬第一醫院,通訊作者單位為中國醫科大學。

研究材料
在該研究中,研究人員構建了單核細胞表達人源CTSD的轉基因小鼠(hCTSDhi)以及CTSD單核細胞特異性敲除的轉基因小鼠(CTSDmKO)(兩種小模型均由賽業生物提供)。體外研究才用了高表達CTSD的THP-1細胞和人腦微血管內皮細胞。
技術方法
研究中采用了包括全外顯子組測序分析、q-PCR、實時雙光子活體成像、組織切片免疫熒光染色共聚焦成像、新物體識別和Y迷宮實驗、電鏡成像等技術。在分子機制研究時他們使用了單細胞測序、質譜分析、Western blotting、體外血腦屏障模型等實驗技術。
技術路線

研究結果
1. 2型糖尿病患者循環血單核細胞中CTSD表達上調
為了評估型糖尿病患者(T2DM)循環血單核細胞的轉錄變化,研究者從糖尿病患者年齡匹配的健康志愿者血液中分離單核細胞。通過轉錄組測序分析發現糖尿病患者循環單核細胞CTSD(組織蛋白酶D)表達升高。CTSD一種普遍分布的溶酶體天冬氨酸蛋白酶,其前提pro-CTSD具有可分泌性。為了明確CTSD與糖尿病微血管并發癥的相關性,研究者進一步從T2DM微血管并發癥患者血液中分離出單核細胞,發現與無微血管并發癥的糖尿病患者相比,微血管并發癥的糖尿病患者的單核細胞中CTSD表達進一步升高。而且發現單核細胞CTSD表達水平與患者的空腹血糖以及糖化血紅蛋白水平呈正相關。

圖1. 糖尿病患者單核細胞CTSD表達增加
2. hCTSDhi轉基因小鼠腦微血管通透性增加
為了探討單核細胞CTSD上調對腦微血管的影響,研究者利用構建了單核細胞表達人源CTSD的轉基因小鼠,命名為hCTSDhi(圖2A)。用CD31抗體對腦切片進行免疫熒光染色,發現hCTSDhi小鼠腦微血管的密度和形態無明顯變化(圖2C)。研究者進一步通過實時的雙光子活體成像實驗評估小鼠腦微血管的血腦屏障的功能。在靜脈注射熒光示蹤劑后FITC-dextran后,研究者發現hCTSDhi小鼠的腦組織中可以觀察到在血管外示蹤劑進行性積累的現象(圖2D),這表明hCTSDhi小鼠的腦血管對熒光示蹤劑滲漏。NeuN抗體免疫染色發現hCTSDhi小鼠海馬區神經元密度顯著下降(圖2I)。同時,新物體識別測試結果顯示hCTSDhi小鼠對新物體的探索減少(圖2J), Y迷宮實驗發現hCTSDhi小鼠在獲得食物獎勵的正確臂內的停留的時間下降(圖2K),實驗結果說明hCTSDhi小鼠存在認知記憶障礙。這些結果表明,單核細胞CTSD的高表達引起腦腦血管滲漏從而損傷神經元,導致認知記憶功能障礙。

圖2. hCTSDhi小鼠腦微血管通透性增加
3. hCTSDhi小鼠腦血管內皮細胞囊泡介導的轉胞吞增強
血管周細胞和星形膠質細胞端足對血管內皮細胞的覆蓋對血腦屏障的維持至關重要。因此,通過CD31和CD13(周細胞標記物)或AQP4(星形細胞端足標記物)的免疫染色來分析周細胞和星形細胞端足的血管內皮細胞的覆蓋率。結果顯示,hCTSDhi小鼠腦周細胞(圖3A)和星形細胞端足(圖3B)的血管覆蓋率保持不變,提示hCTSDhi小鼠腦微血管的通透性增高是由于腦內皮細胞本身變化導致的。對小鼠腦組織進行進行透射電子顯微鏡(TEM)成像,發現hCTSDhi小鼠腦血管內皮細胞中的囊泡顯著增加(圖3E)而緊密連接結構無損傷,這提示該小鼠腦微血管滲漏是內皮細胞中囊泡介導的胞吞增強所致。為了驗證該猜想,研究者進一步進行了示蹤的電鏡成像,在靜脈注射了電鏡示蹤劑HRP后收集小鼠腦組織進行電鏡成像,結果發現hCTSDhi小鼠腦血管內皮細胞中HRP陽性的囊泡顯著增減,然而腦血管內皮細胞間的緊密連接結構這并未見到HRP示蹤劑分布。該結果說明,單核細胞CTSD的高表達增強了腦血管內皮細胞中囊泡介導的轉胞吞作用,而不影響血管內皮細胞間的緊密連接的完整性。
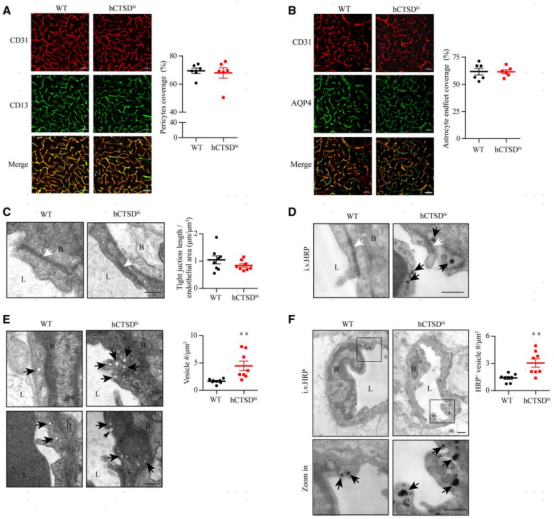
圖3. hCTSDhi小鼠腦血管內皮細胞中囊泡介導的轉胞吞作用增強
4. 腦微血管內皮細胞中Cav1上調導致hCTSDhi小鼠腦血管滲漏
為了探討hCTSDhi小鼠腦血管內皮細胞囊泡介導的轉胞吞增強的分子機制,研究者進行hCTSDhi小鼠腦組織單細胞RNA測序分析。細胞聚類分析顯示,hCTSDhi小鼠腦內內皮細胞百分比略有變化(圖4A)。對內皮細胞簇進行差異基因分析,分析hCTSDhi小鼠腦血管內皮細胞中發現29個上調基因和33個下調基因(圖4B)。基因集富集分析顯示,差異表達基因在內吞途徑(頂部,圖4C)和小窩途徑(底部,圖4C)中顯著富集。在hCTSDhi小鼠腦內皮細胞的差異表達基因中,發現小窩主要結構成分Cav1 (caveolin 1)和Cavin2 (caveolae-associated protein 2)上調,圖4D)。細胞群分析顯示,與野生型對照相比,hCTSDhi小鼠的Cav1+內皮細胞增加的比例高于Cavin2+內皮細胞增加的比例 (圖4E)。內皮細胞群進一步分為靜脈內皮細胞、毛細血管內皮細胞和動脈內皮細胞(上圖,圖4F),發現Cav1在hCTSDhi小鼠的3個內皮亞群中均有升高,其中在毛細血管細胞中升高的比例尤其高(相比野生型小鼠,圖4F)。進一步對腦切片進行免疫染色,結果證實了hCTSDhi小鼠腦微血管中Cav1的表達增加(圖4G)。為了驗證Cav1的上調導致hCTSDhi小鼠腦血管通透性升高,研究者用編碼shRNA-Cav1的AAV-BR1病毒特異性干擾內皮細胞Cav1,然后進行血管通透性分析。發現下調內皮細胞Cav1后,hCTSDhi小鼠腦實質纖維蛋白原沉積和熒光葡聚糖滲漏的現象明顯緩解了 (圖4H和4I)。進一步的TEM分析顯示,hCTSDhi小鼠腦內皮中囊泡的積聚的現象也減輕了。 (圖4J)。綜上所述,這些數據表明,外周單核細胞CTSD的上調增加了腦微血管內皮細胞Cav1,促進了囊泡介導的血腦轉胞吞作用,導致腦微血管通透性增加。

圖4. hCTSDhi小鼠腦內皮中Cav1上調導致胞吞作用增強
5. 單核細胞分泌Pro-CTSD觸發腦血管內皮細胞Cav1介導的轉胞吞作用
高表達CTSD的單核細胞是如何調節腦血管內皮細胞的轉胞吞作用?研究者假設CTSD具有可分泌性,可以由單核細胞分泌到血漿中,然后對腦血管內皮細胞產生作用。因此,作者對T2DM患者的血漿樣本進行了Western blot分析。發現血漿中的CTSD主要以53 kD的pro-CTSD形式存在,T2DM患者血漿中pro-CTSD的含量顯著升高(圖5A)。同時發現hCTSDhi小鼠血漿中也存在高水平的人源pro-CTSD (圖5C和5D)。研究者使用濃度梯度葡萄糖處理的單核細胞系THP-1,發現細胞上清中pro-CTSD的水平表現出葡萄糖濃度依賴性,而具有酶活性的CTSD(CTSD重鏈)的含量卻無明顯變化 (圖5E)。這些數據表明高糖誘發單核細胞過度分泌pro-CTSD。接下來研究者利用慢病毒構建了一個穩定的過表達CTSD的單核THP-1細胞系(命名為CTSDOE),利用該細胞分泌的細胞上清CTSDOE CM評估分泌的pro-CTSD對腦血管內皮細胞的影響。結果發現分泌的pro-CTSD上調腦血管內皮細胞Cav1的表達,增加內皮細胞屏障的通透性。接著研究者又通過qRT-PCR和Luciferas實驗發現,pro-CTSD是在轉錄水平上調腦血管內皮細胞Cav1蛋白(小凹蛋白)的表達的。
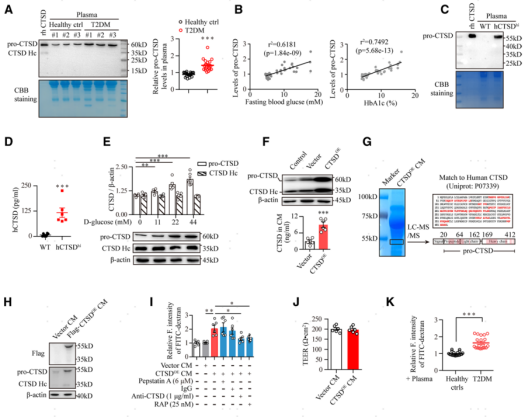
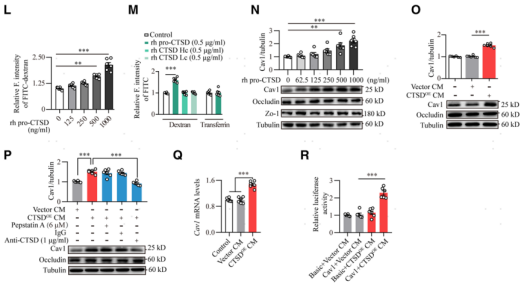
圖5. 糖尿病單核細胞分泌pro-CTSD上調腦血管內皮細胞中的Cav1的表達并促進轉胞吞作用。
6. 分泌的pro-CTSD結合腦血管內皮細胞LRP1受體激活NF-kB信號并上調Cav1表達增強轉胞吞作用
研究者利用質譜分析的方法篩選分布于腦血管內皮細胞表面且可以與pro-CTSD結合的受體蛋白(圖6A),結果發現低密度脂蛋白受體相關蛋白1(LRP1)可以與pro-CTSD相互作用(圖6B)。并進一步通過免疫沉淀和Pulldown實驗發現pro-CTSD主要與LRP1的α亞基的細胞外簇2結合(圖6C)。為了明確pro-CTSD與LRP1結合對腦血管內皮細胞Cav1的上調作用,研究者利用干擾技術抑制了腦血管內皮細胞LRP1的表達,Western blot結果顯示腦血管內皮細胞LRP1的抑制可以有效阻斷抑CTSDOE CM對的Cav1的上調作用(圖6D)。體內實驗也發現類似的效果,利用AAV-BR1病毒特異性沉默腦血管內皮細胞LRP1可以有效阻斷hCTSDhi小鼠腦血管內皮細胞中Cav1的高表達 (圖6G)。同時TEM分析顯示,干擾LRP1可以明顯緩解 hCTSDhi小鼠腦血管內皮細胞囊泡增多的現象 (圖6H)。這些數據表明,pro-CTSD與腦內皮細胞LRP1受體的細胞外結構域2簇結合,促進Cav1介導的轉胞吞作用。接著,研究者又對pro-CTSD與LRP1結合激活的下游信號通路進行探討,發現pro-CTSD與LRP1的結合可以激活腦內皮細胞NF-kB轉錄信號通路,上調Cav1的表達,增強Cav1介導的轉胞吞作用(圖6I-K)。
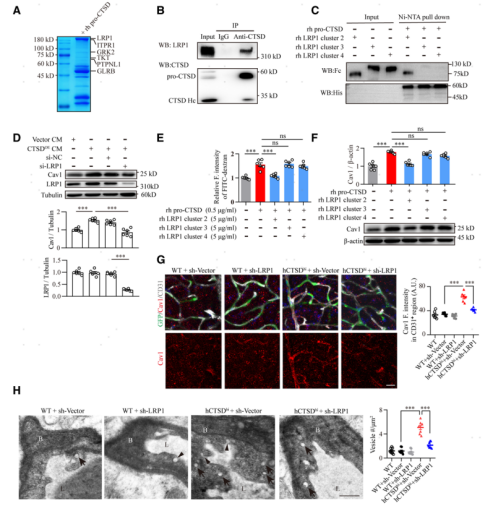
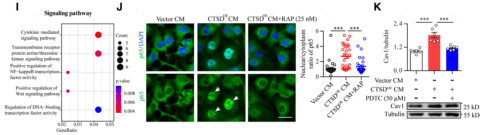
圖6. 分泌的pro-CTSD與LRP1受體細胞外結構域2結合,激活內皮細胞NF-kb信號通路上調Cav1表達,增強囊泡介導的轉胞吞作用
7. 敲出單核細胞CTSD可以緩解糖尿病小鼠腦血管內皮細胞轉胞吞增強,對糖尿病認知功能損傷具有保護作用
接下來,研究者利用LoxP-Cre技術單倍敲除了小鼠單核細胞中的CTSD(構建CTSDmKO小鼠),探討CTSD的下調是否對糖尿病相關的腦微血管損傷具有保護作用。通過qRT-PCR和ELISA檢測可見,CTSD的單倍敲降可以有效的將糖尿病模型小鼠單核細胞中和血漿中的CTSD水平控制在健康對照小鼠的水平(圖7B和7C)。接著研究者又使用FITC-葡聚糖(40 kDa)進行了體內雙光子腦成像,評估CTSD消除后糖尿病小鼠腦微血管的損傷情況。發現CTSDfl/fl對照糖尿病小鼠的血管周FITC-葡聚糖外滲明顯,而糖尿病CTSDmKO小鼠的腦實質中這種外滲明顯減少(圖7D)。并且發現CTSD敲除也可以有效緩解糖尿病小鼠視網膜血管中FITC-葡聚糖的滲漏(圖7E)。透射電鏡分析顯示,糖尿病CTSDmKO小鼠腦血管內皮細胞中囊泡的密度較糖尿病CTSDfl/fl小鼠也明顯下降(圖7F),這說明CTSD的敲出有效緩解了糖尿病誘發的腦血管內皮細胞轉胞吞增強的效應。接著,研究者用NeuN抗體對腦片進行免疫熒光染色,結果顯示糖尿病CTSDmKO小鼠海馬神經元的丟失有所減輕(圖7G)。Y迷宮和新物體識別測試結果顯示,糖尿病CTSDmKO小鼠的記憶和認知能力恢復顯著 (圖7H和7I)。這些結果表明,單核細胞CTSD的敲出可以有效治療糖尿病誘發的腦微血管滲漏并可以緩解糖尿病導致的認知障礙。
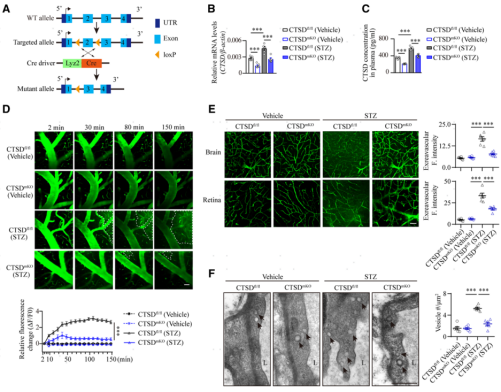
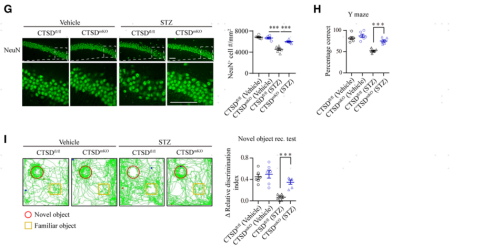
圖7. 敲除單核細胞CTSD可以有效緩解糖尿病小鼠的腦血管滲漏、改善認知功能
研究結論
總之,該研究發現糖尿病時血環血單核細胞CTSD表達升高。單核細胞分泌pro-CTSD與腦血管內皮細胞LRP1受體的胞外結構域2結合,激活NF-kB信號通路,促進Cav1的表達并增強Cav1介導的轉胞吞作用,最終導致腦微血管滲漏并損傷認知記憶能力。該研究為糖尿病腦微血管疾病提供了新的治療靶點和策略。

原文檢索
Zhao D, Huang Z-K, Liang Y, Li Z-J, Zhang X-W, Li K-H, Wu H, Zhang X-D, Li C-S, An D, et al. Monocytes release pro-cathepsin d to drive blood-to-brain transcytosis in diabetes. Circulation research. 2024;134:e17-e33





