“不死癌癥”系統性紅斑狼瘡SLE的介紹及其研究小鼠的應用
去年年底,系統性紅斑狼瘡(SLE)患者沙白因多年來病情控制不佳,而決定赴瑞士“安樂死”,事件一度引發熱議。提到紅斑狼瘡,許多人會很快聯想到“不死癌癥”“蝴蝶斑”等標簽,這些詞匯背后是疾病帶來的真實痛苦與恐懼。
然而,醫學研究與治療的步伐從未停歇。不久前,浙大二院為3名紅斑狼瘡患者進行了兩周三次的CAR-NK細胞輸注治療,并取得了顯著療效。這一突破性進展不僅為患者帶來了新希望,也讓人們對未來充滿信心。
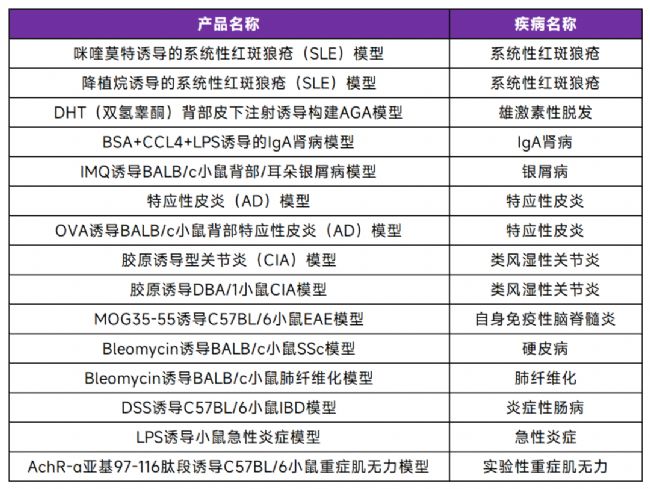
關于系統性紅斑狼瘡
系統性紅斑狼瘡(SLE)是一種復雜的慢性自身免疫性疾病,其特征是免疫系統異常激活,錯誤地攻擊身體自身的組織和器官,導致全身多系統的炎癥和損傷。患者常表現為皮膚紅斑、關節炎、腎臟損害、神經系統異常等癥狀,嚴重時可能危及生命。
SLE的發病機制尚未完全明確,但已知與遺傳、環境因素、激素水平以及免疫系統失調密切相關。由于其病因復雜且臨床表現多樣,研究人員一直在努力尋找更有效的研究模型,以深入探索SLE的發病機制并開發新的治療方法。
SLE動物模型推薦
在SLE的研究中,動物模型尤其是小鼠模型發揮了重要作用。賽業生物構建了咪喹莫特誘導的SLE小鼠、降植烷誘導的SLE小鼠以及MRL/MpJ-Fas敲除小鼠,能夠模擬人類SLE的典型病理特征,且驗證數據穩定,具有較高的可重復性。
誘導造模
通過外源性藥物咪喹莫特誘導,能夠快速引發類似SLE的免疫異常和病理表現;咪喹莫特所構建的模型適用于研究SLE的急性發病機制和早期免疫反應,篩選潛在的治療藥物和評估干預效果。降植烷則是一種自身免疫誘導劑,通過激活B細胞和T細胞的異常活化,模擬SLE的慢性病程;降植烷誘導的模型適用于研究疾病長期進展、免疫調控機制以及慢性炎癥的病理過程。
基因編輯
MRL/MpJ-Fas敲除小鼠模型是通過基因編輯技術靶向敲除MRL/MpJ小鼠的Fas基因而構建,可用于研究FAS在自身免疫性疾病中的作用,為闡明系統性紅斑狼瘡(SLE)病因以及確定FAS信號級聯中治療自身免疫性疾病的潛在治療靶點提供關鍵模型支撐。
咪喹莫特誘導的SLE模型
6-8周BALB/c雌性小鼠耳部多次給與咪喹莫特(IMQ),誘導形成系統性紅斑狼瘡,治療組同步給與潑尼松。實驗期間,定期觀察小鼠生長狀況和體重,收集小鼠外周血和尿液,檢測血清中抗自身抗體(anti-dsDNA)和尿蛋白等。
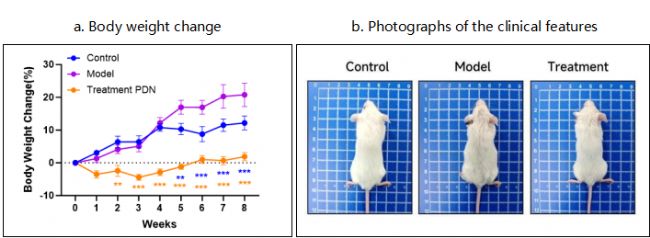
圖1 動物體重變化曲線和動物臨床表型
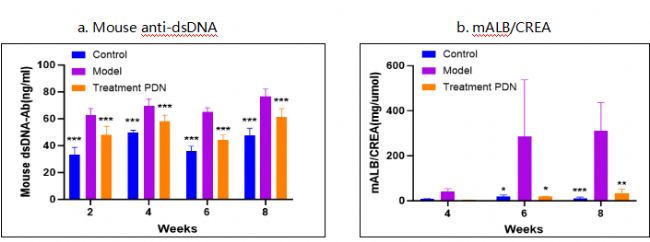
圖2 動物血清dsDNA檢測和尿蛋白檢測
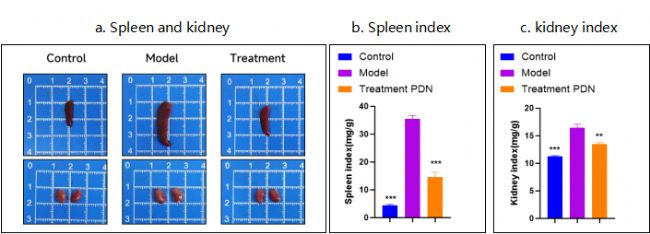
圖3 動物臟器系數
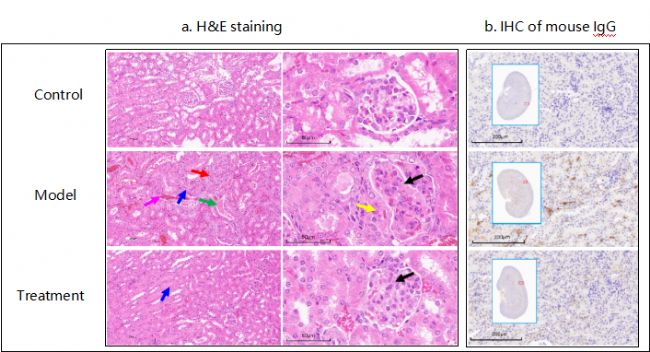
圖4 腎臟病理
降植烷誘導的SLE模型
通過降植烷誘導BALB/c小鼠以構建SLE模型,在造模第6個月后,小鼠腹股溝淋巴結、脾臟明顯增大,面背部脫毛,存在明顯的系統性紅斑狼瘡癥狀。
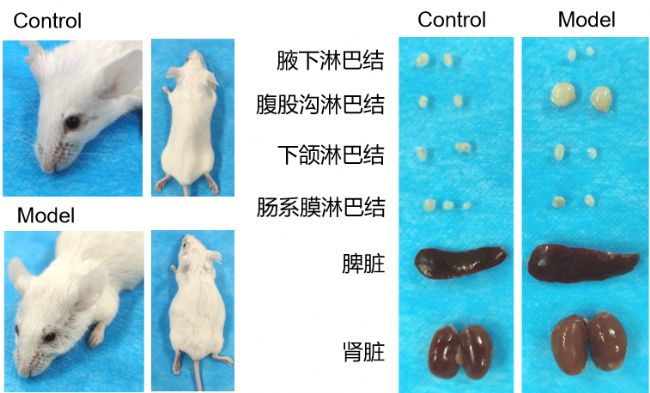
圖5 小鼠表型、淋巴結、腎臟及脾臟變化
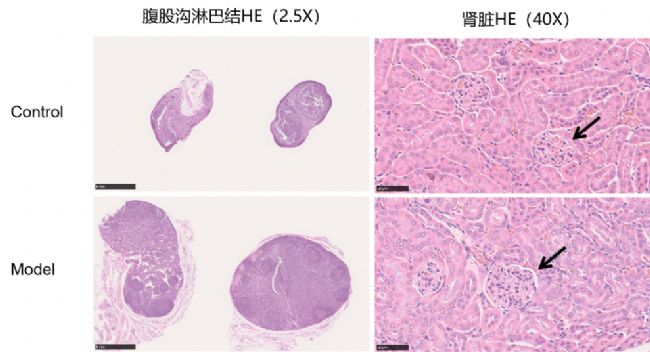
圖6 H&E染色
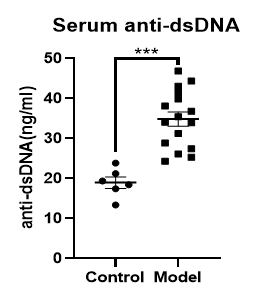
圖7 anti-dsDNA檢測
賽業生物模型豐富的自免及炎癥藥效平臺
藥效評價模型——基因編輯
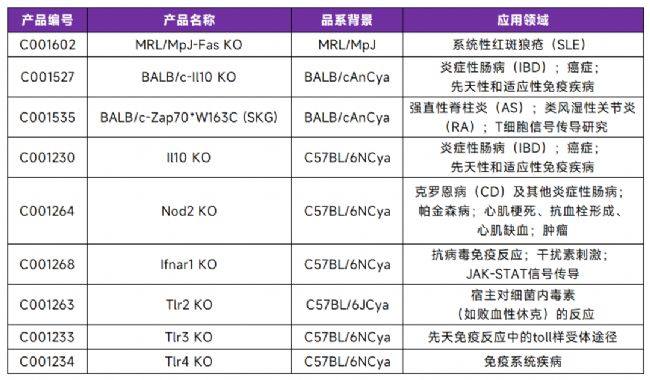
藥效評價模型——誘導造模
藥效評價體外分析服務開展針對不同疾病模型和藥物靶點及相關組織樣本的體外分析,進行的效應性、安全性等研究,為藥效篩選、藥效機制研究和臨床轉化研究提供相關支持。