單細胞懸液制備方法及質量優化方案
隨著流式分析、細胞分選、單細胞組學、質譜流式等研究技術的蓬勃發展,單細胞也在腫瘤免疫學和神經生物學等多個領域成為大眾的焦點,它能夠很好地反映細胞的特異性和異質性。目前,組織(以腫瘤組織為例)制備成單細胞懸液的方法主要有機械解離法、酶解法和化學法(圖1)。
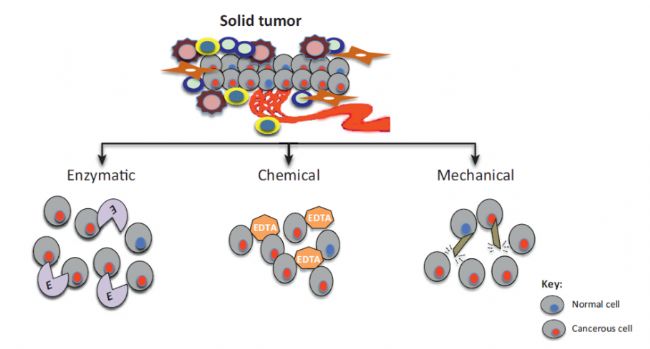
圖1 腫瘤組織制備成單細胞懸液的方法[1]
高質量的初始樣本是實驗成功的關鍵。然而如何在此基礎上,進一步優化粗懸液,獲得高質量的單細胞懸液呢?基于三者的原理以及適用范圍等(表1),我們發現這些方法處理樣本時,沒有統一的標準。就機械法來說,每次實驗研磨的力道稍有不同,對細胞造成的損傷也不一樣,這樣就很難保證實驗的重復性。不僅如此,處理樣本的過程中,細胞可能會出現“死亡、碎片化、粘連”的情況,甚至某些組織如脾臟、心臟等還存在“紅細胞”這一干擾因素。

表1 組織制備單細胞懸液方法的區別
針對這些問題,我們“對癥下藥”,單細胞懸液質量優化的神兵利器主要有以下五種:
1、gentleMACS Dissociator:gentleMACS全自動組織溫和處理器可快速、溫和、安全、自動、便捷和標準化地將組織(如脾臟、肝臟、腫瘤、表皮等)處理成單細胞懸液,可謂是組織樣本處理的絕好幫手。其包含全自動組織解離器、專利解離管和針對不同組織優化的解離試劑盒,以及預設軟件程序在內的整體方案,實現對不同組織樣本的優化解離,確保細胞的活力、功能和表面表位的完好。能夠確保每一次解離都在優化條件,同時解放雙手,結果也可以輕松重復。
2、預分離:粗懸液中的細胞團塊會導致細胞的不完全標記或增加非特異性結合標記而分離得到許多非目的細胞。不僅如此,在一些后續的細胞培養過程中,細胞團塊也會影響細胞的最佳狀態,影響實驗結果。因此,我們可以在粗懸液制備后對其進行預分離,利用細胞濾器或篩網等,去除粗懸液中的細胞團塊。
3、死細胞去除:在二代測序,細胞分選等下游實驗中,死細胞將影響結果的準確性和有效性。死亡的細胞易裂解導致其中的RNA釋放出來,會導致檢測的背景噪聲,進而影響單細胞數據的質量。此外,在細胞分選中,死細胞會影響捕獲細胞計數的準確性,不利于下游的細胞培養和功能驗證等實驗。需要注意的是,當細胞活率<30%時,不建議進行此項操作,去除死細胞后,細胞活率雖然達到90%以上,但大部分細胞都已經死亡,細胞類型及分群會改變。
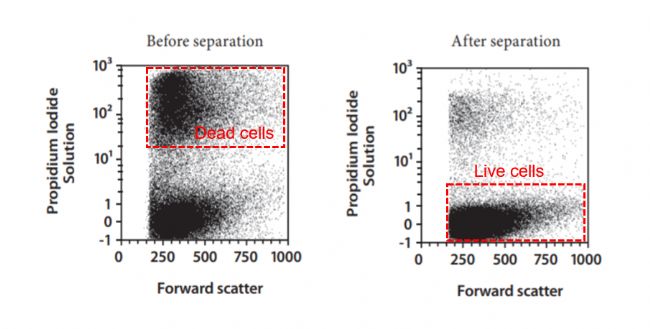
圖2 經熱休克處理的外周血單核細胞(PBMC)死細胞去除前后細胞分群比較[2]
4、去除碎片:機械解離的研磨,酶解法的吹打,甚至是離心過程,都可能會產生細胞碎片。樣本制備過程中產生的細胞團、細胞碎片等會增加微流體芯片的堵塞風險,也會增加流式等實驗中細胞的非特異性標記。我們可以通過嚴格控制上述操作的精度和力度來減少細胞碎片(難度較大),也可以使用細胞碎片去除試劑盒來優化(方便快捷)。

圖3 成年大鼠心臟組織單細胞懸液去除碎片前后細胞群比較[2]
5、紅細胞裂解:諸如脾臟、心臟、肝臟等制備單細胞懸液都會涉及到紅細胞的裂解。紅細胞過多會導致有效細胞識別不準確、有效細胞-非細胞界限模糊、有核率低等問題。

圖4 成年大鼠心臟組織單細胞懸液(已去除碎片)進行紅細胞裂解前后比較[2]
相信有了這些法寶,小伙伴們一定能夠獲得高質量單細胞懸液(表2),順利開展實驗啦!
表2 高質量單細胞懸液質控標準






