活細胞成像用于細胞毒性的研究
從廣義的角度來說,“細胞毒性”是指某種物質對活細胞產生的不健康影響。這種影響可能是指細胞在附著、形態、結構完整性、生長、新陳代謝或增殖等方面的不利變化,這些變化可能最終導致細胞喪失活力(死亡)[1]。細胞毒性可通過測量毒性效應本身(細胞毒性測定)或其對細胞活力的影響(活力測定)來確定。活力測定實際上是對存活細胞數量的量化,與細胞毒性檢測(測量細胞死亡或破壞)中獲得的測量結果成反比 [2、3、4]。
常用的細胞毒性實驗測定一系列的終點指標,如細胞膜破裂后乳酸脫氫酶(LDH)和活性氧(ROS)的產生,線粒體膜電位的損傷等。通過細胞毒性實驗測定細胞毒性對藥物開發與生物研究至關重要。然而,大多數細胞毒性實驗都是在終點測量的,因此很難研究細胞對藥物或化合物的動態反應。動態活細胞成像與傳統的終點測試方法不同,可以通過延時記錄分析細胞死亡隨時間的依賴性變化。Celloger®系列是一款活細胞成像設備,可以在培養箱中同時進行明場和熒光成像(圖2)。該系統有一個全自動攝像頭,可以在用戶設定的時間間隔內對不同位置進行成像。通過使用分析軟件計算捕獲圖像的融合度(%),可獲得隨時間變化的融合度(%)圖。此外,通過測量熒光覆蓋率與熒光強度,可用于分析細胞死亡的發生情況,用以判定細胞毒性。

圖2 Celloger®系列產品
Celloger活細胞成像產品應用:一、Celloger® Mini Plus與CellTox™ Green Dye相結合用于監測Nocodazole的細胞毒性
CellTox™ Green Dye熒光染料可用于檢測由于細胞死亡引起的細胞膜完整性變化,它無法進入活細胞,但可以進入受損細胞使得受損細胞的熒光顯著增強。熒光信號強度可以作為細胞毒性的定量指標,且熒光信號值變化與細胞毒性成正比例相關。該染料可用于檢測長時間藥物處理期間以及用于終點法檢測藥物處理后的細胞毒性作用。
HeLa細胞按1×104個/孔的細胞量進行48孔板的細胞種板。種板培養過夜后,用不同濃度的抗癌藥物Nocodazole( 6.625 nM、31.25 nM、62.5 nM、125 nM、250 nM ) 處理細胞。此時,在樣品中加入CellTox™ Green Dye ( Promega,GB742 ),該染料可與細胞死亡過程中膜完整性受損的細胞的DNA結合。使用安裝在培養箱內的Celloger® Mini Plus在48小時內每隔1小時采集一次細胞圖像,然后使用分析軟件對圖像進行分析。細胞死亡率(%)=熒光覆蓋率(死亡細胞)/明場融合度(總細胞)。
實驗結果表明用不同濃度的Nocodazole處理細胞并進行延時成像,細胞形態呈濃度依賴性變化,在明場視野下觀察到細胞融合度減小(圖3A,B)。此外,用CellTox™染料對死亡細胞進行熒光成像并量化,結果顯示熒光細胞的比例隨著細胞凋亡而增加(圖3C)。
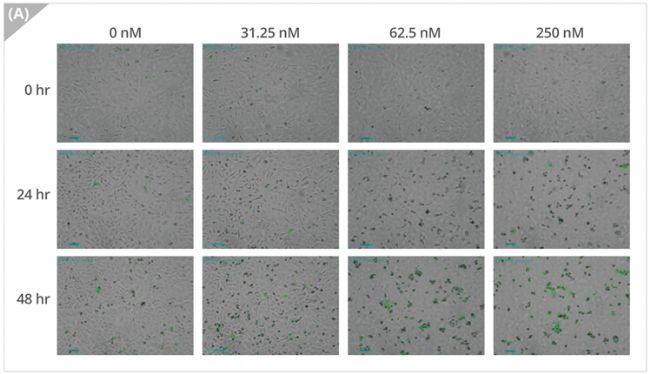
圖3A 各濃度Nocodazole的明場與熒光視野圖像
(圖像顯示以24h為間隔時間,綠色熒光表示死亡細胞。比例尺,200 μm)
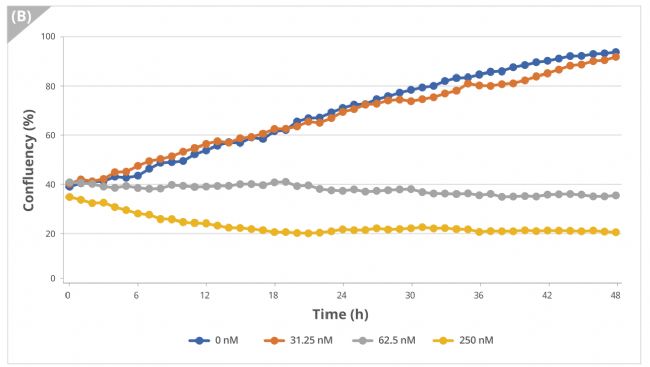
圖3B 細胞隨時間變化的融合率(%)數據圖
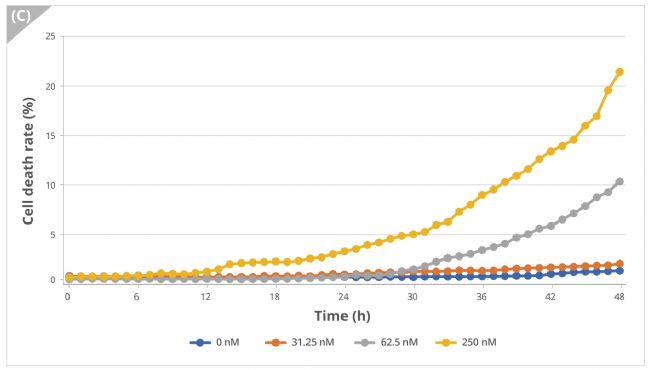
圖3C 細胞死亡率(%)的數據圖
二、Celloger® Nano監測細胞毒性
用紅色熒光染料對死亡細胞進行染色,來測量細胞毒性。死亡細胞的細胞膜高度受損,因此可以在細胞結構中看到紅色熒光。使用Celloger® Nano監測HeLa細胞的細胞毒性,間隔拍攝時間為1小時,總記錄時長71小時。紅色熒光表示細胞死亡(圖4)。
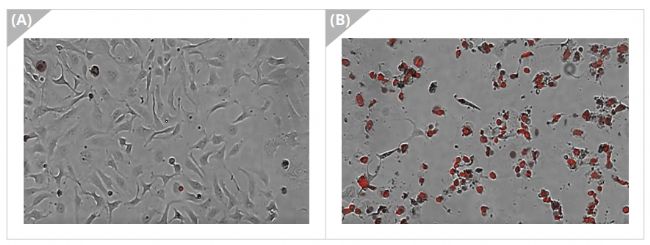
圖4 細胞毒性監測(A)仍然有一部分活細胞,(B)大部分都是死細胞(紅色熒光)
后續我們將為您繼續介紹活細胞成像系統在不同研究下的應用實例,敬請關注。
參考文獻:
[1] Eisenbrand, G.; Pool-Zobel, B.; Baker, V.; Balls, M.; Blaauboer, B.; Boobis, A.; Carere, A.; Kevekordes, S.; Lhuguenot, J.-C.; Piet-ers, R. Methods of in Vitro Toxicology. Food Chem. Toxicol., 2002, 40(2), 193-236.
[2] Freshney, R.I. Culture of Animal Cells : A Manual of Basic Tech-nique. 4th ed. Wiley: New York, 2000.
[3] Niles, A.L.; Moravec, R.A.; Riss, T.L. Update on in Vitro Cytotox-icity Assays for Drug Development. Expert Opin. Drug Discov., 2008, 3(6), 655-669.
[4] Miret, S.; De Groene, E.M.; Klaffke, W. Comparison of in Vitro Assays of Cellular Toxicity in the Human Hepatic Cell Line Hepg2. J. Biomol. Scr., 2006, 11(2), 184-193.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com