誘導多能干細胞(iPSC)相比自體和異體來源干細胞在細胞治療上的優勢
原創:硬核小蜜鋒 文章來源:干細胞之父
在醫療手術中,移植自己的細胞或組織,往往意味著安全高效,但凡事并不絕對。比如間充質干細胞療法,使用“自體”與“異體”就各有優勢,選擇也因人而異。通常而言,年齡與身體狀況是重要的參考指標,一般40歲以上,或身體伴有疾病與亞健康狀態時,不建議使用自體干細胞,反之可選。為什么會有這樣的結論?本篇文章就將結合過往研究,與您詳細探討異體與自體干細胞之間的選擇問題。
毫無疑問,間充質干細胞(MSC)是疾病治療領域冉冉升起的一顆新星。
2022年,《Signal Transduction and Targeted Therapy》(影響因子:40.8)一項綜述[1]稱MSC是治療神經系統疾病、呼吸系統疾病和肺纖維化、代謝/內分泌相關疾病、骨關節炎和心血管疾病的“潛力股”[1]。而在全球范圍內,以干細胞對抗衰老也已經成為一種趨勢,一種風尚。
 △《Signal Transduction and Targeted Therapy》是《Nature》旗下的新期刊
△《Signal Transduction and Targeted Therapy》是《Nature》旗下的新期刊不過談到具體應用時,人們卻分成了兩派——有人偏向使用自體MSC,堅稱:“自產自用”更安全,回輸的干細胞更不容易被機體代謝。而“異體派”則認為:使用嬰兒圍產組織來源的異體MSC是在“變廢為寶”,不但繞過了繁瑣的采集,還獲取了生物學特性更優異的MSC。
事實上,兩者提到的觀點都具有一定的道理。只是生活總存在各類變量,比如年齡、身體狀況,使用時效,患者承受能力等等,它們會影響干細胞的使用,也會將這個問題引向不同的答案。
01 衰老與疾病
自體干細胞的兩道“枷鎖”
間充質干細胞(MSC),是自然組織修復再生系統的基礎之一。憑借著強大的自我更新和多向分化能力,它能向成骨細胞、成肌細胞、脂肪細胞、軟骨細胞等成基質譜系細胞分化。而除了出色的“可塑性”之外,MSC還具有免疫調節和抗炎的特性。
更難得的是,它的來源很廣泛,在成年人的牙髓、脂肪、骨髓中都能發現它的身影。
這意味著,我們能從自己的身體里獲得“良藥”,并以自然的方式去“糾正”機體的疾病,修復內里的損傷,既沒有倫理風險,也幾乎不存在副作用。
這些優秀的特性吸引了大批的科學家,他們陸續將自體干細胞應用于治療糖尿病、心腦血管疾病、神經退行性疾病等等疑難雜癥,并頗有建樹,自體干細胞也被陸續寫入心力衰竭、下肢慢性缺血性疾病等疾病的專家共識里。
然而,在干細胞研究這股浪潮之中,研究者們也發現了自體干細胞的局限。
自體干細胞受限于年齡
我們體內的干細胞并不是一層不變的,其數量及功能都會隨著年齡的增長而出現“斷崖式”的滑坡。這種耗竭用數字圖形表現起來非常直觀,讓我們逐一來看。
1、數量驟降95%
2007年,間充質干細胞之父Arnold Caplan測定了從出生到80歲的骨髓間充質干細胞(BM-MSC)的含量[2]。
在新生兒期,人體骨髓MSC含量最高,每1萬個骨髓細胞里有1個是BM-MSC;而到了80歲,每200萬個骨髓細胞里只能挑出1個BM-MSC。換句話說,80歲老人的骨髓MSC含量僅有新生兒的兩百分之一,這也是為什么老年人骨折恢復特別緩慢的重要原因。
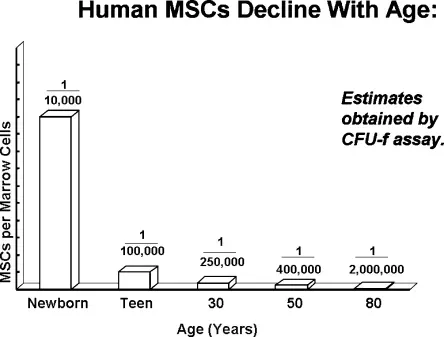
△人類骨髓中間充質干細胞含量隨年齡變化圖
2、擴增能力顯著下降
強大的擴增能力是產生足量干細胞,滿足臨床治療需求的基礎,此前,亞利桑那大學醫學院曾將參與者按照年齡分組,分別檢測了來自年輕組(<30歲),成年組(35-50歲)和老年組(>60歲)脂肪間充質干細胞(AT-MSC)的擴增能力[3]。
他們發現,對比40歲以下的AT-MSC,50歲以上的AT-MSC表現出明顯的衰老特征,如:SA-β-gal活性是鑒定衰老細胞最常用的生物標志物,而后者的含量幾乎是前者的兩倍多。
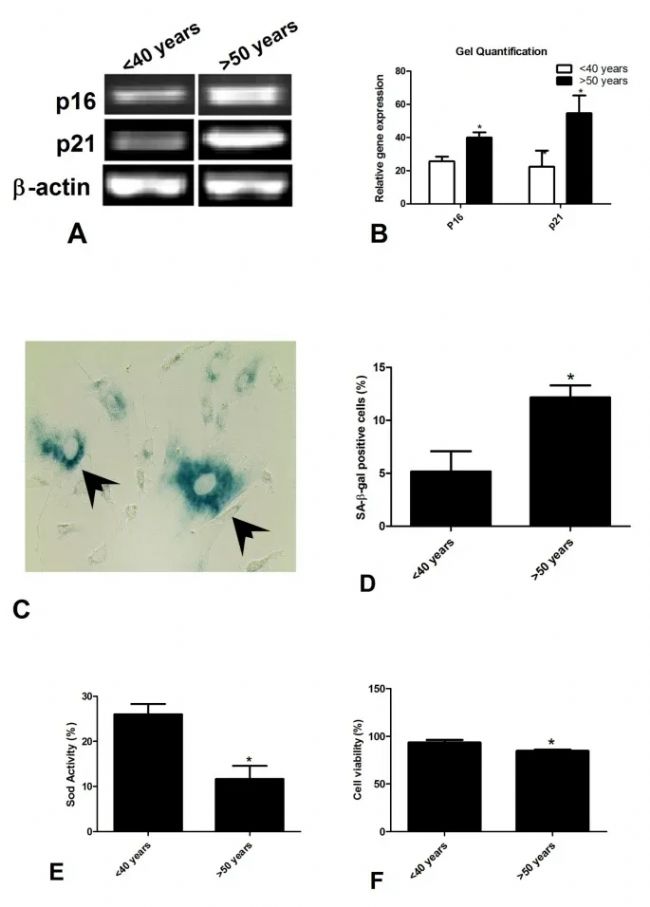 △從年輕和老年供體分離的AT-MSC中年齡相關參數的比較
△從年輕和老年供體分離的AT-MSC中年齡相關參數的比較在隨后的擴增測試中,年輕組和成年組的干細胞也不出所料地擴增出更大的細胞集落,相較而言,老年組的細胞增殖速度更慢,細胞倍增時間顯著增加,最后生成的集落也很小。
3、分化能力顯著下降
亞利桑那大學醫學院還就不同年齡段MSC的分化能力做了進一步分析,具體評估AT-MSC向脂肪細胞、骨細胞、軟骨細胞及神經細胞分化的能力。其中成脂的分化潛能與年齡無關,但在比較后三者時,老年干細胞的“頹勢”再次浮現。
向成骨細胞分化時:年輕組比成年組與老年組產生了更多的基質。同時RT-PCR分析顯示,年輕的AT-MSC中成骨特異性基因的表達更高,以及骨鈣素和堿性磷酸酶倍數表達。
向軟骨細胞分化時:老年組在軟骨基質形成和軟骨相關基因表達方面顯著落后,比如在聚集蛋白聚糖的表達上,年輕組:10.0 ± 1.5;成年組:4.3 ± 0.2;老年組:1.8 ± 0.4。綜合結果表明:供體年齡負向調節AT-MSC向軟骨分化。
向神經細胞分化時:無論供體年齡如何,AT-MSC都表現出神經元樣分化,具有突出和細長的神經元結構,然而其他研究表明:在后期傳代誘導AT-MSC擴增時,年輕的AT-MSC細胞還是優于老年細胞。
 △供體年齡對 AT-MSCs 成骨潛力的影響
△供體年齡對 AT-MSCs 成骨潛力的影響以上研究不難看出,年齡就像是干細胞質量的一道道門檻,隨著歲月漸長,體內干細胞數量、及其擴增和分化能力都會有不同程度的下滑,甚至腰斬。而這種改變勢必會影響到干細胞治療的效果。
自體干細胞受限于供體健康
除了年齡之外,一些疾病的存在也會“重創”體內的干細胞。
2017年,《Stem Cells Translational Medicine》(影響因子:6.9)上有一則研究就證實[4]:長期患有2型糖尿病會降低干細胞的增殖能力、免疫抑制潛力及存活率。文章明確建議:當病患患有糖尿病超過10年且較為肥胖時,不再適合使用自體干細胞進行治療。
除此以外,有文章還稱從系統性紅斑狼瘡、類風濕關節炎和特發性血小板減少性紫癜患者骨髓中分離出的MSC存在異常形態,并伴有增殖速度減慢、和免疫調節功能下降的態勢。
這一點,從研究治療的選擇也能窺見端倪。在2022年發布的《異體間充質干細胞治療系統性紅斑狼瘡專家共識》中曾提到:我國利用MSC治療系統性紅斑狼瘡患者共有695例,其中691例接受異種MSC移植,只有4例接受自體MSC。
所以綜合來看,如果你年紀不超過40歲,且身體健康(沒有影響干細胞質量的疾病或亞健康狀態),那么自體間充質干細胞會是一個很好的選擇,除此之外,則建議選擇異體間充質干細胞。
02 “異”軍突起
異體干細胞打開成藥可能性
聽到異體,許多人第一反應是要配型,這里我們要明晰一個概念:與造血干細胞不同,回輸異體MSC是不需要配型的,因為MSC的免疫原性很低——不表達白細胞抗原HLA-DR,且僅表達可以忽略的HLA-A、HLA-B,因此,即使異體使用也不會觸發免疫排斥反應。
這道“豁免金牌”極大地拓寬了異體MSC的使用范圍,也讓自體與異體研究的數量走勢總體相當,而到近些年,異體MSC研究甚至隱隱有超越之勢。
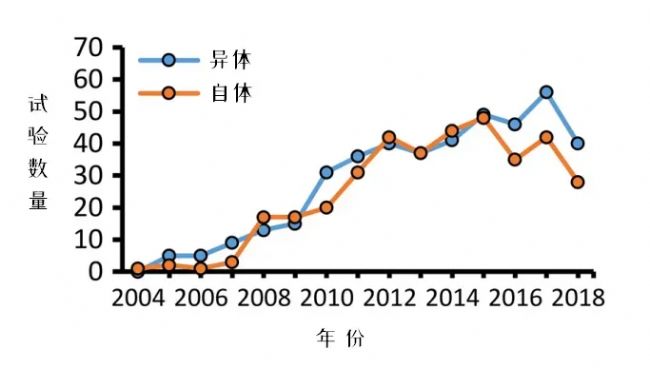 △2004-2018年間充質干細胞臨床試驗趨勢
△2004-2018年間充質干細胞臨床試驗趨勢為什么會這樣?這其實是多因素造成的結果。
首先,異體MSC多源自于嬰兒的圍產組織,如胎盤、臍帶和羊膜等,這類MSC素有“零歲細胞”之稱,生來沒有“年齡焦慮”。
2021年,愛爾蘭國立大學曾對比臍帶間充質干細胞(UC-MSC)、脂肪間充質干細胞(AT-MSC)和骨髓間充質干細胞(BM-MSC)之間的生物學特性[5],他們發現:
1、論增殖能力:UC-MSC>AT-MSC>BM-MSC;
2、論免疫原性:UC-MSC的HLA抗原表達最低,并不容易被免疫系統清除;
3、論免疫調節:UC-MSC>AT-MSC和BM-MSC;
4、論抑制炎癥:UC-MSC、BM-MSC和AT-MSC都能有效抗炎,只是機制略有不同;
5、論分化潛能:存在一種由表觀遺傳因素驅動的“組織記憶”效應,驅使BM-MSC易分化為成骨細胞和軟骨細胞,AT-MSC易分化為脂肪,UC-MSC則比較特殊,它在分化為成骨細胞及軟骨細胞上能壓過BM-MSC,并具有相對較高的胰腺再生和神經再生潛力。
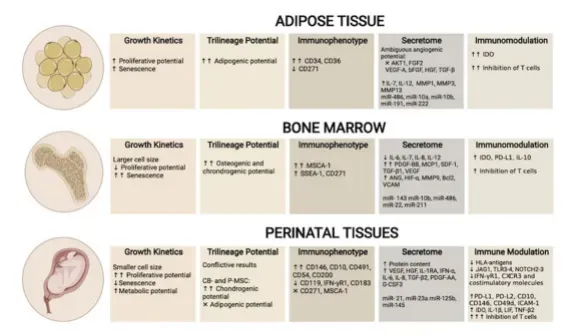
△ UC-MSC、AT-MSC及BM-MSC生物差異性對比,圖中額外增加表面標志物對比
所以對比其他組織來源的MSC,UC-MSC應該是臨床中泛用性更強,生物學特性更優異的間充質干細胞。
其次,在生物學特性之外,異體MSC比自體MSC更具有時效性。作為“一對一”的定制化治療,自體MSC治療要經歷多個步驟:從患者體內采集干細胞——在實驗室培養(約4周)——進行治療等步驟,這通常需要耗費一個月以上,對于需求迫切的急性疾病(如脊髓損傷、心肌梗塞等)而言,這是“致命”的缺陷。
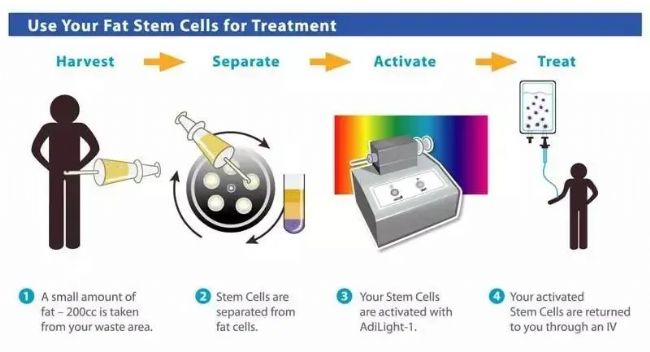 △ 圖片為自體脂肪干細胞制備的過程,每個病患都將是一個獨立的生產線
△ 圖片為自體脂肪干細胞制備的過程,每個病患都將是一個獨立的生產線相較而言,異體MSC所有的生產流程都可以發生在“有需求”前,生產藥企會提前從健康供體身上提取MSC,通過分離,擴增等步驟將其制備成藥,而后,這些藥品會被放置于倉庫凍存,靜待“隨取隨用”,因此,異體MSC是真正有望實現批量化、規范化生產的“細胞藥品”。
最后與采集繁瑣程度有關,自體干細胞的采集通常使用“骨髓穿刺”和“抽脂手術”,我們以程度較輕的抽脂舉例,手術時,醫生會將一根空心金屬管(直徑從1mm到10mm不等)伸入患者的皮下脂肪層,一邊“搗爛”脂肪,一邊連血帶脂地抽出脂肪組織。這番景象常常會“勸退”患者,而異體MSC直接省略掉了這一步驟。
△ 抽脂其實也是一種需要麻醉的外科手術
不用配型,較好生物學特性及便捷高效的使用,這些優勢打開了異體干細胞成藥及治療更多疾病的可能性,也讓其成為了目前干細胞治療的有力選擇。
總的來說,在能保障細胞質量的前提下,無論異體MSC還是自體MSC都能給予患者非凡的益處。但基于每個人不同的情況,40歲以下,且身體健康可選自體MSC ;40歲以上,或身體存在疾病或亞健康狀態可選異體MSC。
03 集優點于一身
iPS技術開創治療新路
而隨著再生醫學的發展,我們或許不再需要于自體與異體當中“擇優而選”,一個同時具備“自取自用”及“優異生物學特性”的選項開始浮現,它就是誘導多能干細胞(iPSC)。
21世紀初,日本京都大學教授山中伸彌通過四個轉錄因子(OCT4、SOX2、KLF4和c-MYC),抹去了成熟纖維細胞的發育痕跡,使其退回到類似胚胎干細胞(ESC)的狀態,即iPSC。
iPSC擁有不輸ESC的“全能分化性”,能在適當的誘導下分化為動物體內幾乎所有細胞類型,比如心肌細胞、胰島細胞與神經細胞,當然也包括本文的主角——間充質干細胞(iPSC-MSC)。
這極大地拓寬間充質干細胞的來源,它意味著,我們可以無視供體的年齡與身體狀況,只需用iPS技術將供體細胞轉變為iPSC,并進一步誘導,就可以得到具有年輕遺傳特征的iPSC-MSC。
與天然的MSC相比,iPSC-MSC的具有諸多優勢,據國際期刊《Stem Cell Research & Therapy》今年10月發表的一篇論文[6]表示:
1、iPSC-MSC具有更強的增殖能力,并減少了與年齡相關的變化和異質性。
2、分化能力方面,iPSC-MSC的脂肪分化能力較強;在免疫相關功能方面,iPSC-MSC表現出更強的免疫抑制能力。與UC-MSC相比,iPSC-MSC的抗炎因子表達更高,這使得它們在治療免疫相關疾病中更具潛力。
 △ 論文:誘導多能干細胞來源的間充質干細胞:能否成為細胞治療的新星
△ 論文:誘導多能干細胞來源的間充質干細胞:能否成為細胞治療的新星這種優勢也延續到了疾病治療里面。研究者發現:iPSC-MSC所展現的功能與傳統MSC類似,同樣具有調節免疫反應和促進組織修復,也同樣在治療缺血和炎癥相關病癥——如心肌梗死、下肢缺血、炎癥性腸病和急性肺損傷等疾病上展現出不俗的潛力。而得益于突出的性質,iPSC-MSC在骨關節炎、椎間盤退變等研究中的治療效果要優于傳統MSC。
豐富的來源、充足的數量、良好的治療效果、高度同質性、還有能夠有效解決免疫排斥及倫理問題,iPSC-MSC就像一個集“自體”與“異體”優勢于一體,且生物學特性還要更上一層樓的“最佳選項”,被科學家們視作未來細胞療法的關鍵細胞來源,也引領著干細胞新的治療方向。
參考資料:
[1]Stem cell-based therapy for human diseases.https://022-01134-4
[2]Adult mesenchymal stem cells for tissue engineering versus regenerative medicine
[3]Donor age negatively impacts adipose tissue-derived mesenchymal stem cell expansion and differentiation.https://76-12-8
[4]Type 2 diabetes mellitus duration and obesity alter the efficacy of autologously transplanted bone marrow-derived mesenchymal stem/stromal cells.https://-0506
[5]When Origin Matters: Properties of Mesenchymal Stromal Cells From Different Sources for Clinical Translation in Kidney Disease. https://21.728496
[6]Induced pluripotent stem cell-derived mesenchymal stem cells: whether they can become new stars of cell therapy. https://024-03968-x
內容來源華夏源干細胞,旨在科普相關知識,傳遞行業前沿進展,不作為醫療指導建議,如需就醫請到正規醫院就診。





