高速Maldi成像——優化藥物研究中的樣品分析時間
Rohan Thakur,Bruker Daltonics執行副總裁
在過去的幾十年中,MALDI-TOF質譜(基質輔助激光解吸/電離飛行時間)已在大量應用中證明了它的有效性和穩健性,并幫助生命科學家應對了最嚴峻的挑戰。諸多公司和學術機構依靠諸如MALDI-TOF和MALDI-TOF/TOF質譜系統等儀器來加速其研究。病理學、生物標志物研究、藥物表征等領域的科學家,試圖對腫瘤異質性進行描繪,并將這些信息與疾病結果聯系起來。基于蛋白質分布的組織成像仍然是應對這一挑戰的最強大的分析技術之一。
本文將重點討論新的激光技術是如何提高MALDI成像的樣本通量的。它將揭示MALDI技術作為一種成熟的技術是如何在藥物開發中應用于化合物分布分析,以及作為一種新興工具如何提高藥物發現過程的效率,特別是應用于超高通量藥物篩選中。
當前的挑戰
MALDI成像是一種空間分辨、無標記分析技術,可直接對生物樣品進行分析。而采集速度和樣品通量是質譜成像(MSI)實驗中的限制性因素,特別是在臨床研究中。因為臨床研究需要分析大量患者的樣本,以消除個體差異。利用質譜成像進行臨床導向的轉化醫學研究嚴重依賴于分析速度以及穩健的操作。當前儀器存在的局限性限制了它的充分應用。必須突破這種局限性,才能使科學家能夠更好地從事高通量的臨床研究。
采集速度也是高空間分辨率的MSI實驗的制約因素,特別是對于較大組織切片的分析。新的MALDI成像解決方案標志著在生產力、經營成本和易用性方面的范式轉變,使質譜成像成為個性化醫學研究的強大而可靠的信息源。
創新的MALDI分析技術
MALDI在制藥環境中具有廣泛的適用性。如今,這種離子化技術被用于超高通量篩選、吸收、分布、代謝和排泄(ADME)應用中的先導化合物發現,以及生物制藥的質量控制,或被用于臨床微生物鑒定等生物/臨床診斷。以上這些應用都對包括速度、結果分析時間、通量、易用性、明確性和穩健性等有很高的要求。
儀器市場正在積極響應并解決科學家關于提高樣品通量并提高數據質量的需求,以幫助他們在最短的時間內做出最好的決定。新的質譜成像解決方案重新定義了MALDI成像的關鍵性能指標,成像速度比傳統MALDI-TOF系統提升了10倍,且同時不會損失靈敏度。
化合物分布分析
雖然MALDI成像分析應用涵蓋范圍很廣,但其共同點都是評估 分子在不同組織類型中的空間分布。MALDI成像是一種可直接從組織切片中檢測潛在的生物標志物的分析技術,它在過去的十年中得到了普及。針對酶解產物空間分辨的實驗流程的優化成為研究熱點。最重要的是,對臨床病理學中最常見的樣品類型 — 福爾馬林固定石蠟包埋(FFPE)的病理組織,可通過原位酶切實現對FFPE組織中的肽的分析。此外,它還能使用肽作為替代物來對較大的蛋白質進行檢測,并借助MS/MS來促進生物標志物的鑒定。
傳統儀器的采集速度僅為2像素/秒,漫長的儀器運行時間成為制約成像實驗的瓶頸和挑戰。如果常規研究中樣品數目不止一個,就將很快會達到儀器運行的極限。此外,空間分辨率的提高意味著單位面積像素數目的增加以及像素直徑倒數平方值的增大。所以,無論是將科學成果進行常規化應用,還是應對在更高空間分辨率下減少激光光斑大小的需求,更高的采集速度都是必須的。
此外, MALDI成像具有的更高的分子特異性也是非常有益的。現在正在探尋利用高分辨和MS/MS采樣模式來實現高的分子特異性,這要求儀器具有更快的數據采集速度,尤其是在MS/MS模式下依然保持這樣的數據采集速度。
圖1顯示了MALDI MS/MS模式下成像采集的一個實例,它顯示了在利用胰蛋白酶原位酶解組織切片后的的肽段ARTKQTAR在組織上的分布。值得注意的是,在空間分辨率為30μm的情況下,采集全部32000個像素僅花費33分鐘。采集時間只有原來的5-10之一,使整個實驗能在一個工作日內完成。它提供了一個可用來評估并優化原位組織酶解方案的強大工具。

圖1:H33_小鼠的肽ARTKQTAR的MS/MS質譜成像圖(母離子m/z: 931.54 Da -> [b+18] 碎片 m/z 775.4 Da)
質譜成像解決方案 - 數據示例
以下實例來自新一代MALDI-TOF樣機的初始數據,它能在10μm及以下像素尺寸下達到每秒50像素(圖譜)的采集速度。所示數據來自最常見的MSI應用領域,包括脂質、肽和完整蛋白質分析。
方法
樣品制備和基質應用是參照以前公布的標準程序進行的。在脂質和完整蛋白質分析中,將10μm厚的新鮮冷凍組織切片安放在導電載玻片上,并用自制升華裝置將DHB基質沉積在組織表面。對于蛋白質,當基質沉積后,在恒濕試驗箱中用乙酸(5%)進行額外的再水化步驟。而在肽分析中,則將FFPE組織薄切片(4μm)安裝在載玻片上。依據標準操作流程,對樣品進行石蠟去除和抗原修復(Tris緩沖液,pH 為9)之后,使用ImagePrepTM 裝置(Bruker Daltonik GmbH,德國不來梅市)對樣品進行酶解并涂覆HCCA基質。所有MS成像數據都是在Bruker的新一代MALDI-TOF儀器(rapifleX MALDI TissuetyperTM)的樣機上采集的。該儀器是配備新型10kHz smartbeamTM 3D激光器,具有線性/反射模式,而該激光器使用經過優化的激光束聚焦透鏡產生窄聚焦(<5μm直徑)高斯分布的激光斑點。結合一組旋轉鏡片,激光斑點可以快速精確地定位在樣品上,從而實現真正的方形像素。
結果
基于MALDI-TOF的組織成像的三個主要應用領域的初始數據如圖所示,其主要差異在于樣品制備和所分析的m/z范圍。
·脂質分析(約500-1,500 m/z)通常以小像素進行,以達到最高的空間分辨率(圖2)。
·完整蛋白質分析(約2,000-20,000 m/z)。由于MALDI離子的低電荷狀態和其它類型分析器的質量截留效應,通常采用MALDI/TOF儀器,如rapifleX MALDI Tissuetyper(圖3)。
·(胰蛋白酶解)多肽分析(約500-4,500 m/z)是獲取FFPE組織信息的主要途徑。通常酶解步驟限制了空間分辨率(圖4)。
該平臺的性能基于以下標準:
·以高采集速度和高空間分辨率生成一致的、帶空間信息的圖像。
·在激光照射后仍能保留組織完整性,以便隨后的常規組織學檢測。
·在數據采集中和采集后,在合理的時間內,具有對大型MSI數據集處理、分析并可視化的分析能力。
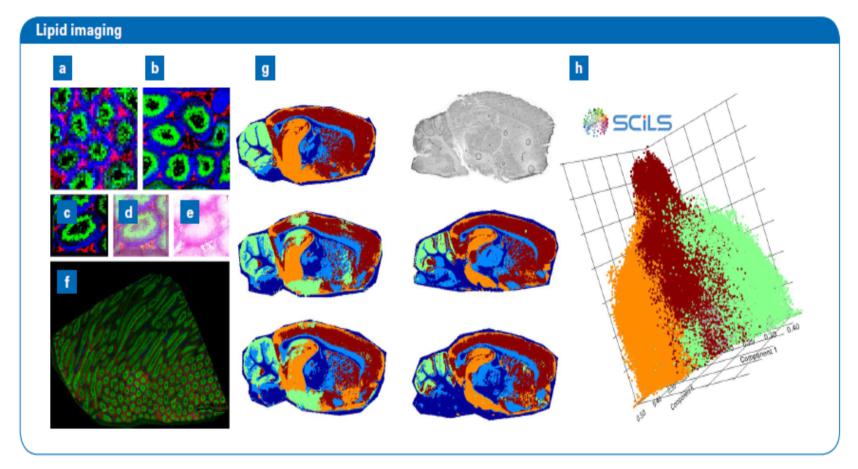
圖2:在不同的像素大小(a-c,按比例顯示)對大鼠睪丸進行的分析。在25μm(a)時,組織結構不能清晰地顯示,表明需要更高的分辨率。在10μm時,可見清晰形態(b)。即使在最小的像素尺寸(5μm,c-e)下,組織完整性仍被完全保留。10μm像素大小下,獲取一個大型檢測結果(0.4 cm2, 394,629像素)僅耗時137分鐘(48像素/秒),顯示了高度穩定的數據質量(f)。五只小鼠腦切片(總像素594,434)測量用時約4小時(43像素/秒),導入常規臺式PC利用SCiLS Lab 2015b分析和可視化用時約2小時。這里展示的是分割圖(g)以及所有圖譜的主成分分析結果,顯示皮質、海馬體和小腦組織的分離(h)。
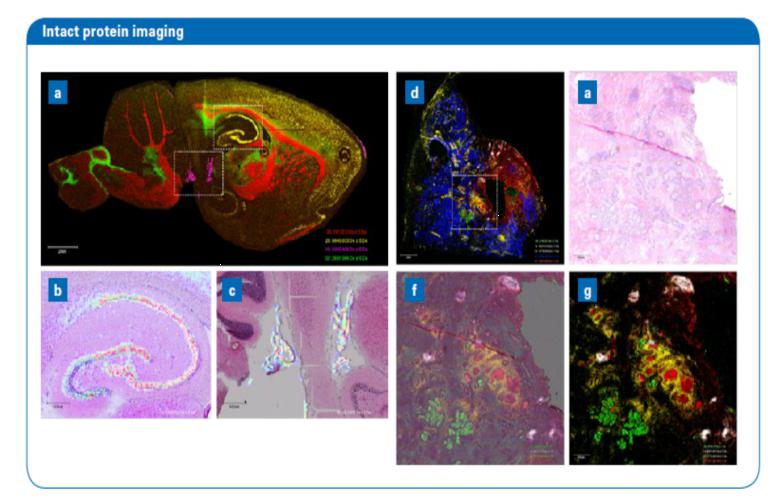
圖3:矢狀大鼠腦切片(1.36 cm2),以30μm像素大小(151,164像素)進行分析(a)。總采集時間約4h(約11像素/秒)。其中四處離子的分布具有高度區域性,可以清楚地顯示出微妙的結構,如海馬錐體細胞層(b)和室管膜(c)。樣品由Julian Langer(馬克斯·普朗克生物物理研究所,法蘭克福)提供。rapifleX MALDI Tissuetyper能在一個可行的時間范圍內對較大的擴散性腫瘤樣本進行分析。以30μm像素大小進行的(248,825像素)人類前列腺癌(2.24 cm2)分析(d-g)。總采集時間約8h(約8.5像素/秒)。離子分布顯示了纖維肌組織(藍)、腫瘤細胞(綠)、鰓內粘液材料(紅)和邊緣區域(黃)。樣品由Axel Walch(亥姆霍茲慕尼黑中心)提供。

圖4:以30μm像素大小(180,002像素)分析感染棘球絳蟲的人類肝臟組織(1.62 cm2)(a)。總采集時間約2h(約24像素/秒)。包蟲囊腫明顯與宿主組織(灰)分離。在較高放大倍數中的圖像中(b,c),囊腫的宿主(紅)和寄生蟲層(藍)清晰可見。人肺癌TMA(d)。以50μm像素大小(51,932像素)分析了99個單獨的核。5個多肽m/z值的分布如圖所示。TMA代表了對來自大量患者的樣品進行高通量分析的一種獨特可能性。在這里,我們產生的數據約為1病人/分鐘。樣品由Jörg Kriegsmann(Proteopath GmbH,特里爾)提供。
腫瘤異質性分析是腫瘤學和個性化醫學領域最重要的生物醫學研究挑戰之一。MALDI成像極其適合于獲取腫瘤異質性的無偏分子視圖。MALDI儀器可提供更高的速度和性能,使科學家有可能以足夠高的空間分辨率對大型腫瘤標本進行分析,以獲得對腫瘤異質性的全面理解。
提高藥物發現過程的效率
MALDI儀器運用的新激光技術不僅提高了MALDI成像的速度,還能應用于藥物發現過程的最初階段。藥物發現的過程包括在某種疾病的背景下,就相關的各種酶對幾百萬純化合物進行測試。這種篩選十分耗時,因此,尋找進一步藥物開發的先導化合物的代價十分高昂。
質譜儀器已經用于超高通量藥物發現篩選。與原先的MALDI-TOF儀器相比,融合了最新技術改進的新型MALDI-TOF質譜實現了更高的采集速度和穩健性。這將2,000,000次篩選活動的耗時縮短到大約1周(取決于,例如每個樣品激光照射次數或每塊靶板可容納的樣品數量(384 vs 1536 vs 6144))。在一個實例中,在使用6144靶板進行這樣的二百萬次篩選活動之后,無需清洗透鏡組1,從而實現最高水平的通量連續性。
達到成像性能的新高度
質譜成像解決方案,如rapifleX MALDI-TOF質譜系統,可提供高采集速度(高達每秒50個真實像素以實現更快更好地成像);≤10 μm的像素大小因而實現最高空間分辨率以獲取生物信息;無重疊以及準正方形像素,從而在高通量和高空間分辨率下提供穩定的圖像質量。3D激光器確保了像素到像素的再現性,同時作為一種全新設計的離子源,也提供了更高穩健性。
目前先進的TOF/TOF系統已從基礎開始重新設計,以滿足當今對深度完整和自上而下的蛋白質表征、以及對高性能、高通量質譜成像(MSI)的最高要求。新一代系統可提供更高的速度、更高的質譜分辨率和精度,并顯著提高MS/MS質量范圍,以實現新的研究和常規應用。研究人員需要高速度和離子源的穩健性、更寬的動態范圍、更高的特異性和分辨率,這些都有助于生物和臨床相關性脂質、肽和蛋白質的詳細表征。
科學家們曾期望有這樣一種系統,它能提供深度蛋白質表征及對組織、細胞培養物或其它應用領域的成像研究。而MALDI成像作為行業引領者,具有更好的易用性、穩健性和穩定性,這對于科學研究和大規模驗證都至關重要。從藥物發現過程的最初階段、高通量篩選(HTS),以及藥物成像——從識別潛在的候選藥物到驗證它們在組織中的分布和毒性,MALDI都大有可為。
參考文獻:
1. P. Marshall, M. Leveridge, C. Haslam, G. Clarke, J. Chandler, A. Dunn, N. Hardy, M. Pemberton, S. Dikler, J. Fuchser, Ultra High Throughput Drug Discovery Screening by MALDI-TOF Mass Spectrometry – Exceeding One Million Samples per Week, Poster W-T-223 , 第二十一屆國際質譜大會;加拿大多倫多市;2016年8月20至26日。
Ends
作者簡介
布魯克道爾頓公司的執行副總裁。Thakur博士擁有超過20年的質譜經驗,包括14年的質譜開發經驗并在離子光學領域擁有多項專利。在加入布魯克之前,他曾在Thermo公司擔任過全球營銷主管負責質譜解決方案,還在一家醫藥研發機構做了2年藥物研發主管。Thakur博士從堪薩斯州立大學化學系獲得博士學位,并在羅格斯大學進行博士后研究,在那里他的工作涉及到使用高分辨率質譜分析證明開環苯代謝物——DNA和蛋白質加合物的形成。
Email: Rohan.Thakur@bruker.com
關于Bruker公司
50多年來,Bruker已幫助科研人員取得可提高人類生活品質的突破性發現,并開發出諸多新的應用。Bruker的高性能科研儀器和寶貴的分析解決方案,使科研人員得以在分子、細胞和微觀水平上開展對生命和材料的探索。
通過與客戶的密切合作,Bruker致力于幫助實現創新、生產力提升以及客戶成功,領域涉及生命科學分子研究、制藥應用、顯微鏡、納米級分析、工業應用,以及細胞生物學、臨床成像、臨床研究、微生物學和分子診斷。更多信息,請訪問:http://www.bruker.com。
標簽:
高速Maldi成像
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





