免疫印跡實驗相關原理介紹
免疫印跡(Western blot)簡介和原理
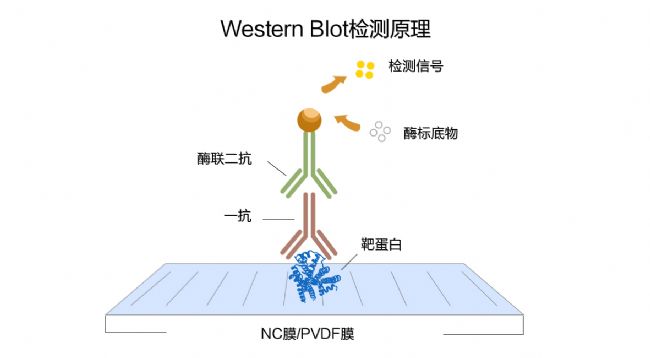
免疫印跡用于鑒定能夠與特異性抗體相互作用的大分子抗原(一般為蛋白質)并測定抗原的大小。蛋白質首先通過SDS聚丙烯酰胺凝膠電泳分離,再通過電泳轉移到固相支持物上,固相支持物包括硝酸纖維素膜,聚偏乙烯二氟(PVDF)膜和陽離子尼龍膜等。首先把膜上未反應的位點封閉起來以抑制抗體的非特異性吸附,這樣固定的蛋白即可與特異性的多克隆或單克隆抗體相互作用。最后通過放射,生色或化學發光的方法進行定位。
實驗常規試劑
1. 1.0 mol/L Tris•HCl (pH6.8)
2. 1.5 mol/L Tris•HCl(pH8.8)
3. 10% SDS
4. 10% 過硫酸胺(AP)
7. 還原型 5XSDS 上樣緩沖液
8. 10X電泳液緩沖液
9. 10X轉膜緩沖液
10. 1X轉膜緩沖液
11. 10XTBS緩沖液
12. 1XTBST緩沖液
13. 封閉緩沖液: 1X TBST 含5% w/v 脫脂牛奶或者1X TBST 含2%-5%的牛血清白蛋白(BSA)。
14. 一抗/二抗稀釋緩沖液: 常規稀釋液使用的是含5% BSA 或5%脫脂牛奶的1X TBST,見一抗/二抗說明書;每種Elabscience®抗體都有固定的最佳稀釋比例。
操作步驟
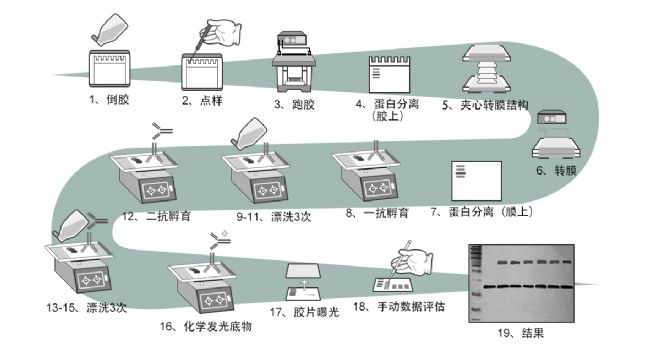
1. 根據待測蛋白分子量大小確定凝膠(分離膠)濃度制膠
2. 上樣 使用適當的裂解液以及裂解方法裂解貼壁細胞、懸浮細胞或者組織樣品。
3. 跑膠: 濃縮膠推薦用 80 伏電壓,待樣品進入分離膠后,可用 120-180 伏。
4. 跑膠完成以后,需先將膠上無樣品的多余部分切除,濾紙和海綿需要預先潤濕。
5. 分離的多肽轉移至膜載體上
選擇合適的膜
轉膜:以NC膜為例
提前十分鐘到半小時用轉膜 Buffer 潤洗 NC 膜
按照以下的結構來安裝轉膜體系:負極-海綿-三層濾紙-膠-膜-兩層濾紙-海綿-負極。
6. 轉膜,一般為 2 小時。
7. 轉完后將膜用1×麗春紅染液染5 min(于脫色搖床上搖)。然后用水沖洗掉沒染上的染液就可看到膜上的蛋白。 將膜晾干備用。
8. 抗原檢測
免疫印跡膜上非特異性蛋白質結合位點的封閉:
a. 轉好的膜先用 TBST 潤洗兩次,每次五分鐘。低速水平搖床,常溫。
b. 用 5%的脫脂牛奶(TBST 配制)常溫封閉一至兩小時。封閉過程應在常溫下置于轉速較低的水平搖床。
抗體與抗原特異性結合:一抗孵育
9-11.用 TBST 洗膜三次,每次十分鐘。
12. 常溫下用二抗孵育一到兩個小時。
13-15. 用 TBST 洗膜三次,每次十分鐘。
16. 準備 ECL 底物,對 8×5 cm 的膜,2毫升(1 毫升 A 加1 毫升 B)足夠。將膜浸潤底物中 1 分鐘,然后取出,用濾紙吸掉膜上多余的底物。
17. 用 x-ray 底片曝光,根據信號的強弱適當調整曝光時間,一般為1 min或5 min,也可選擇不同時間多次壓片,以達最佳效果;曝光完成后,打開X-光片夾,取出X-光片,迅速浸入顯影液中顯影,待出現明顯條帶后,即刻終止顯影。
Western blot常見問題分析指南
為什么電泳的條帶很粗?
電泳中條帶很粗是常見的事,主要是未濃縮好的原因。
處理辦法:適當增加濃縮膠的長度;保證濃縮膠貯液的pH正確(6.7);適當降低電壓;
為什么電泳電壓很高而電流卻很低呢?
這種現象一般初學者易出現。比如電壓50v以上,可電流卻在5mA以下。主要是由于電泳槽沒有正確裝配,電流未形成通路。包括:a.內外槽裝反;b.外槽液過少;c.電泳槽底部的絕緣體未去掉(比如倒膠用的橡膠皮)。
處理辦法:電泳槽正確裝配即可。





