Nature最新研究綜述:蛋白基因組及其臨床應用的光明前景
蛋白基因組(proteogenomics):將蛋白質組與基因組等組學分析手段進行整合,用以系統地檢測腫瘤組織等生物樣本中分子的狀態與變化,進而實現從基因變異到蛋白功能改變與調控的完整描繪,用以發現疾病的分型、標志物及藥物靶點,探索更精準的疾病診斷與治療手段。近三年,Nature、Cell、Cancer Cell等頂級期刊陸續發表了近20篇基于蛋白基因組的癌癥精準醫學研究成果。繼2021年4月,Cell以“The next horizon in precision oncology: Proteogenomics to inform cancer diagnosis and treatment”(點擊閱讀)發表綜述觀點文章后,Nature Reviews Cancer (IF 60)于近日再次綜述了癌癥蛋白基因組的研究進展及其未來的光明應用前景。
基因組分析推動了對驅動突變的識別和靶向治療的發展,對癌癥的治療產生了巨大的影響。然而,腫瘤中絕大多數體細胞突變和拷貝數變異的功能仍然未知,并且對靶向治療產生耐藥性的原因以及克服它們的方法也不清楚。基于質譜的蛋白質組學的改進,可以直接檢查基因組畸變的后果,提供對腫瘤組織的深入和定量的表征。蛋白質及其翻譯后修飾與基因組、表觀基因組和轉錄組數據的整合,構成了精準癌癥解析的新領域,并且已經帶來了新的生物學認知和診斷知識,展示出了對腫瘤惡性轉化和治療結果深入理解的巨大潛力。該篇綜述描述了蛋白基因組的最新進展,在一系列癌癥研究中的主要發現,以及相關的分析方法與技術。蛋白基因組在轉化研究中的應用和免疫癌癥學領域正在迅速興起,其完全融入治療試驗和臨床應用的前景看起來是一片光明的。
基因組分析推動了對驅動突變的識別和靶向治療的發展,對癌癥的治療產生了巨大的影響。然而,腫瘤中絕大多數體細胞突變和拷貝數變異的功能仍然未知,并且對靶向治療產生耐藥性的原因以及克服它們的方法也不清楚。基于質譜的蛋白質組學的改進,可以直接檢查基因組畸變的后果,提供對腫瘤組織的深入和定量的表征。蛋白質及其翻譯后修飾與基因組、表觀基因組和轉錄組數據的整合,構成了精準癌癥解析的新領域,并且已經帶來了新的生物學認知和診斷知識,展示出了對腫瘤惡性轉化和治療結果深入理解的巨大潛力。該篇綜述描述了蛋白基因組的最新進展,在一系列癌癥研究中的主要發現,以及相關的分析方法與技術。蛋白基因組在轉化研究中的應用和免疫癌癥學領域正在迅速興起,其完全融入治療試驗和臨床應用的前景看起來是一片光明的。

綜述內容
癌癥蛋白基因組學,將基于質譜的蛋白質豐度和翻譯后修飾 (PTM) 測量與基因組、表觀基因組和轉錄組數據相結合的方法,用以分析來自腫瘤模型和臨床的腫瘤樣本。基因組和表觀基因組為可能發生的事情提供了藍圖,而蛋白質組提供了對發生的事情的確定,因為蛋白質及其修飾是生物表型的主要最終決定者。基因組和轉錄分析提供了對基因組改變的特征和潛在影響的解讀,而蛋白質組提供了有關蛋白質調節和響應這些變化的信號的直接信息。重要的是,蛋白質組還提供了對 PTM 的深入、定量的分析,例如磷酸化、乙酰化和泛素化。這些分析可以檢測由基因組變化或更接近的影響驅動的信號網絡,并可以提供有關影響細胞信號、位置、分子復合物形成、翻譯和穩定性的修飾的信息(DNA或mRNA 分析無法揭示的失調)。以及通過檢查激酶、泛素連接酶和其他酶及其PTM 異常表達的信息學方法,可以將注意力集中在可立即成藥的靶標上,或集中精力開發新療法。因此, 蛋白質組學有可能為治療反應提供重要見解,并在臨床環境中診斷多種耐藥來源。從目前的研究及臨床應用來看,基因組測序對診斷、預后和治療決策的影響比最初希望的要小,免疫癌癥學方法也需要考慮癌癥基因組和免疫系統之間的相互作用。綜上所述,蛋白基因組提供了新的機會。
1. 蛋白基因組的研究進展
在乳腺癌、結腸癌和卵巢癌的早期蛋白基因組的研究發布后,已發表了一系列針對各種癌癥類型的蛋白基因組“景觀”研究。這些研究系統地分析和整合了基因組、轉錄組、蛋白質組和蛋白翻譯后修飾(PTM)數據,以進一步了解疾病發病機制并確定每種癌癥類型的治療靶點。這些研究已經建立了通用的方法,改進了包括:癌癥亞型分類;探索免疫微環境;推斷新抗原庫;檢查 DNA、RNA、蛋白質和PTM水平的協調調節,以及蛋白質組特異性或 PTM 特異性調節;并確定癌癥驅動因素和治療靶點。涉及的蛋白基因組的分析內容如下:

這些研究不僅對疾病的機制和生物學過程提供了深度、完整的見解,還利用蛋白質組和磷酸化蛋白質組發現了新的潛在治療靶點,發現了治療人群選擇和預后的標志物,評估了癌癥的免疫“景觀”,以及利用多組學重新定義了癌癥的分型。部分已發表的蛋白質基因組研究,對癌癥的解析及亮點羅列如下:
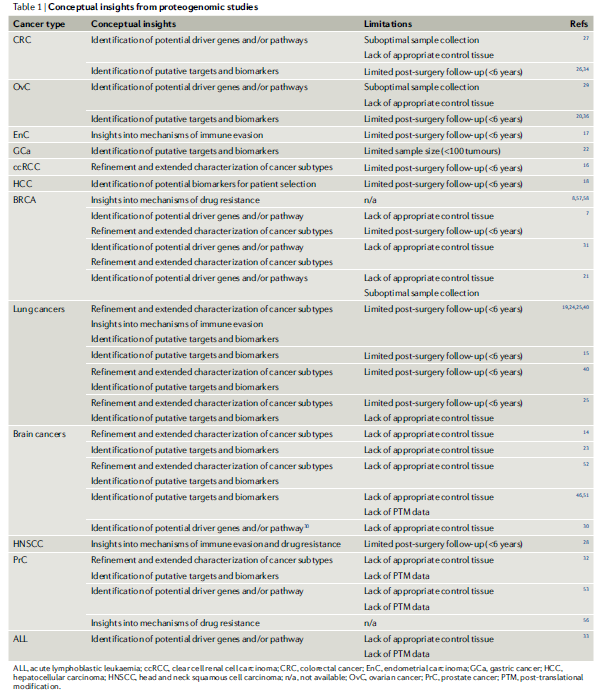
值得注意的是,許多癌癥蛋白基因組的研究強調了蛋白質組學,尤其是 PTM 在描繪癌癥生物學和確定潛在治療靶點方面的關鍵作用。當前的癌癥臨床實踐幾乎完全由基因組學驅動,但蛋白質組分析提供的額外信息,則清楚地報告了RNA-蛋白質之間相對較低的相關性。早期的研究報道了RNA-蛋白質相關性平均在0.3-0.45范圍內。高度相關的基因-蛋白質產物來自氨基酸和脂肪酸代謝途徑,而管家核糖體和剪接體途徑富含相關性非常低的基因-蛋白質對。多項研究表明,在 mRNA 和蛋白質中具有相似穩定性的基因往往具有更高的 RNA-蛋白質相關性。具有低 mRNA-蛋白質相關性的基因往往是泛素-蛋白酶體途徑的靶點或受 miRNA 調節。更詳細的mRNA-蛋白質相關性綜述可參見Nat Rev Genet 21, 630–644 (2020)。
2. 走向臨床應用
為了解決臨床假設,并朝著臨床實用性邁進,首先要考慮的是快速冰凍的隊列樣本能夠得到統一規范化地處理。III期臨床試驗的樣本有必要為基于蛋白基因組學的臨床實踐提供一級證據。但這需要在正確標本的積累等方面得到保障,包括精心設計和注釋的臨床數據,以解決相關的轉化目標。同時需要在分析技術上,實現OTC包埋活檢樣本中的蛋白質組(包括PTM)數據的有效獲取。為解決這些問題,多項努力正在進行中。當在發現隊列中發現了一些假說和證據后,下一步的分析就會涉及用靶向蛋白質組(如MRM、PRM)和多重免疫的方法進行驗證。此外,在單細胞水平上,進行RNA和DNA序列分析的可靠方法已經出現,其通量足以對數百到數千個單細胞進行測序,而在單個細胞水平上分析大約1000個蛋白的蛋白質組學方法也已經開始出現。樣品處理、色譜和質譜儀器的進一步改進,將很快以合理的通量實現單細胞蛋白質組分析,從而為整合基因水平的數據實現單細胞水平的蛋白基因組奠定基礎。
總結
雖然數百個樣本的單類癌癥,以及數千個樣本的各類癌癥的蛋白質基因組分析,已經獲得了大量分子數據信息,代表了重大的科學成就,但蛋白基因組仍然是一個新興領域。與基因組學的早期一樣,bulk水平的分析可能會對癌癥生物學產生重要且可操作的見解,但需要更多的數據來識別不太常見或細微的致癌過程,需要進行蛋白基因組維度的腫瘤內異質性的探索。越來越多的國際性合作,可以確保種族和環境等因素具有更廣泛的代表性,從而更好地研究癌癥的蛋白質基因組多樣性。蛋白翻譯后修飾(PTM) 分析可能最有希望揭示癌癥相關途徑的細微調節。當前蛋白基因組景觀研究中所提出的生物學觀察和治療假設,都需要進一步研究和驗證。在可預見的未來,隨著更多的癌癥和癌癥類型進行蛋白基因組分析,更多的PTM被檢測,泛癌的蛋白基因組研究獲得更多的信息,蛋白基因組技術將會越來越多地應用于解決轉化背景下的特定臨床問題。最終,隨著這些方法和技術的成熟,預計蛋白質組將成為癌癥診斷和治療中更不可或缺的一部分,在個體患者水平上提供精確的靶向治療,并利用基因組學和蛋白質組學數據的結合對該患者的癌癥進行全面描述。
中科優品推薦
【中科新生命】可提供基于蛋白基因組、蛋白質組的多組學整合分析和數據挖掘,為疾病分子圖譜描繪、分子分型、標志物與藥靶發現提供助力。

Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





