哮喘相關動物模型的介紹及其在探究哮喘新療法中的應用
支氣管哮喘(簡稱哮喘)是一種由多種細胞(如嗜酸性粒細胞、肥大細胞、T淋巴細胞等)及細胞組分參與的慢性氣道炎癥性疾病,具有異質性和氣道高反應性特征。其核心病理表現為氣道炎癥、氣道重塑及可變性氣流受限,臨床以反復發作的喘息、胸悶、咳嗽等癥狀為主,常在夜間或凌晨加重,多數患者可經治療緩解[1]。
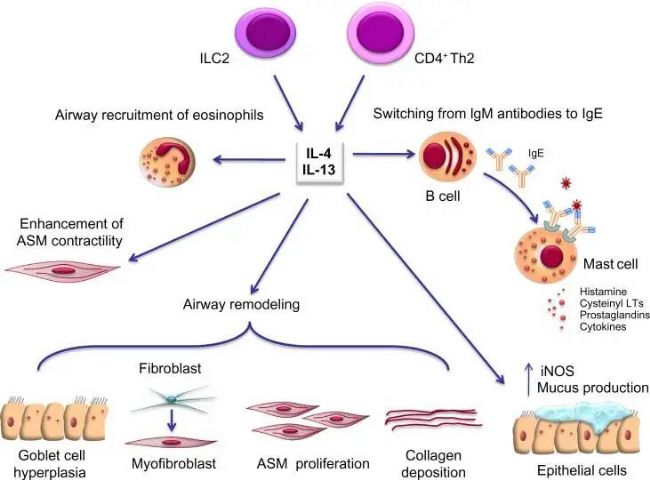
圖1. IL-4和IL-13在哮喘病生理學中的多重作用[2]
哮喘核心發病機制涉及嗜酸性粒細胞異常活化釋放陽離子蛋白、肥大細胞脫顆粒,以及氣道上皮細胞、T淋巴細胞亞群等免疫活性細胞介導的級聯反應,形成以IL-4/IL-5/IL-13為主導的Th2型免疫應答,最終引發粘液高分泌、氣道重塑及IgE合成等典型病理改變。遺傳易感性(超過100個易感基因位點)、表觀遺傳調控(DNA甲基化修飾)與環境暴露(過敏原/污染物/呼吸道感染)構成哮喘的"三重互作網絡"。特別值得關注的是,氣道重塑引發的不可逆性氣流阻塞已成為當前臨床治療難點——現有藥物對氣道基底膜增厚、平滑肌增生等結構性改變的干預效果有限,這驅動著針對TSLP、IL-33等新型生物靶點的藥物研發[3]。
南模生物哮喘相關動物模型
優質的哮喘疾病模型是藥物評價的良好工具,常用的造模方式是采用屋塵螨提取物(HDM)、卵清蛋白(OVA)等構建小鼠哮喘模型。南模生物炎癥/自身免疫疾病評價平臺自主研發了多種哮喘小鼠模型,在不同品系(C57BL/6,hIL4/hIL4R mice,BALB/c)中進行了驗證,可用于哮喘治療藥物的藥效評價。部分數據如下:
/ 基于hIL4/hIL4R人源化小鼠的哮喘模型及Dupilumab單抗的藥效研究 /
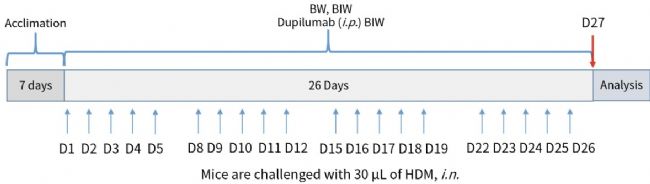
圖1. 基于hIL4/hIL4R小鼠構建HDM誘導的哮喘模型。
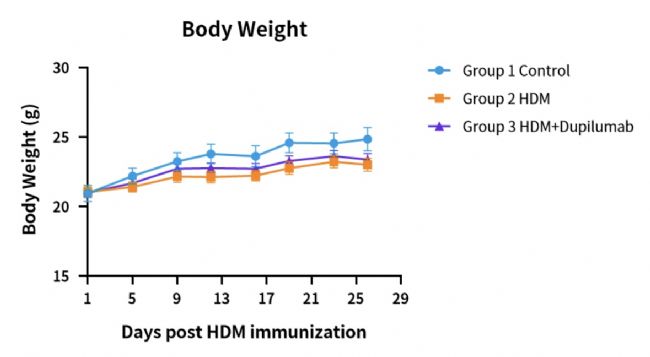
圖2. HDM誘導的hIL4/hIL4R小鼠哮喘模型的體重。
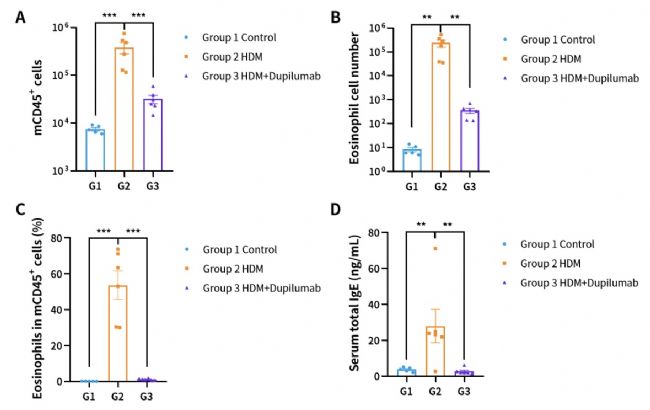
圖3. HDM誘導的hIL4/hIL4R小鼠哮喘模型肺泡灌洗液(BALF)中免疫細胞的數量。(A)BALF中的CD45+細胞的數量;(B)BALF中的嗜酸性粒細胞;(C)嗜酸性粒細胞占CD45+細胞的比例;(D)血清總IgE濃度。

圖4. HDM誘導的hIL4/hIL4R小鼠哮喘模型。(A)H&E染色代表圖。(B)病理評分結果。
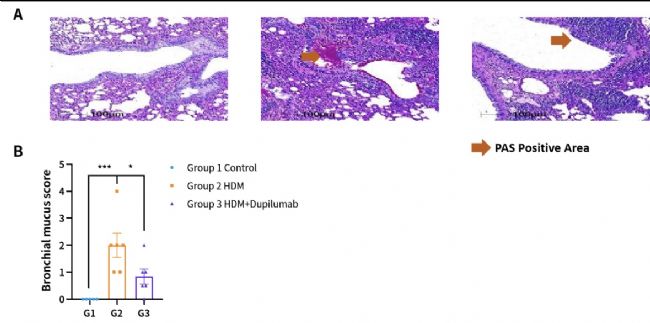
圖5. HDM誘導的hIL4/hIL4R小鼠哮喘模型。(A)PAS染色代表圖。(B)支氣管黏液評分。
/ OVA誘導的BALB/c小鼠哮喘模型及Dexamethasone藥效研究/
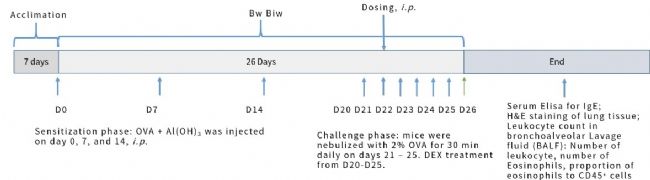
圖6. OVA誘導的BALB/c小鼠哮喘模型。
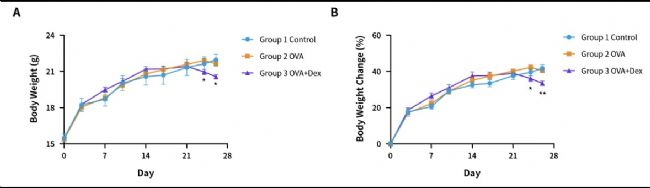
圖7. OVA誘導的BALB/c小鼠哮喘模型。(A)體重;(B)體重變化。
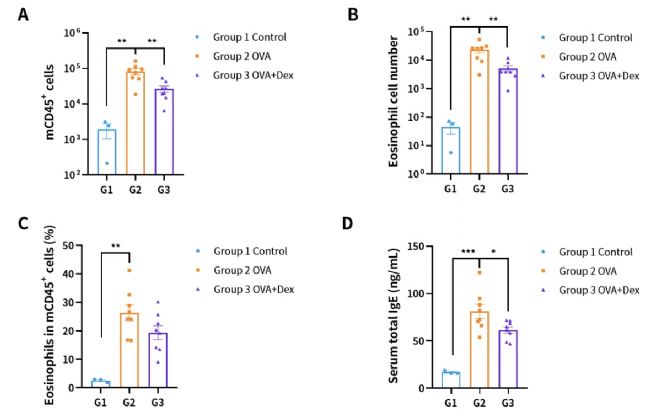
圖8. OVA誘導的BALB/c小鼠哮喘模型肺泡灌洗液(BALF)中免疫細胞的數量。(A)BALF中的CD45+細胞的數量;(B)BALF中的嗜酸性粒細胞;(C)嗜酸性粒細胞占CD45+細胞的比例;(D)血清總IgE濃度。
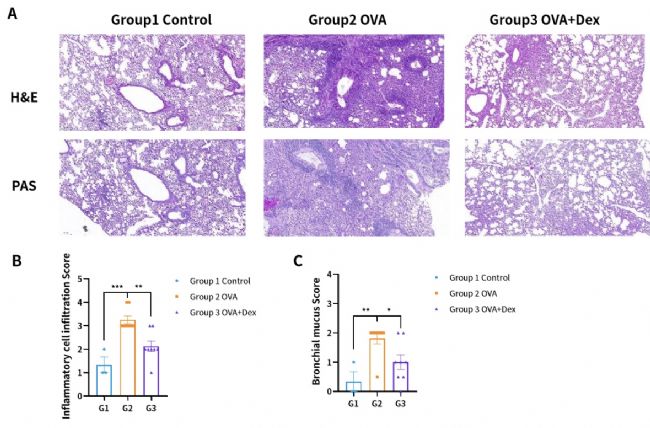
圖9. OVA誘導的BALB/c小鼠哮喘模型。(A)肺部H&E及PAS染色;(B)炎癥細胞浸潤評分;(C)支氣管黏液評分。
如您有相關需求,歡迎撥打400-728-0660或者關注微信公眾號點擊在線咨詢,我們的專業團隊將竭誠為您服務!
Reference:
[1] Martinez FJ, Collard HR, Pardo A, et al. Idiopathic pulmonary fibrosis. Nat Rev Dis Primers. 2017;3:17074. Published 2017 Oct 20. doi:10.1038/nrdp.2017.74
[2] Vatrella A, Fabozzi I, Calabrese C, Maselli R, Pelaia G. Dupilumab: a novel treatment for asthma. J Asthma Allergy. 2014;7:123-130. Published 2014 Sep 4. doi:10.2147/JAA.S52387
[3] Durrant, D.M.and D.W.Metzger,Emerging roles of T helper subsets in the pathogenesis of asthma. Immunol Invest, 2010.39(4-5):p.526-49
關于我們
上海南方模式生物科技股份有限公司(Shanghai Model Organisms Center, Inc.,簡稱"南模生物"),成立于2000年9月,是一家上交所科創板上市高科技生物公司(股票代碼:688265),始終以編輯基因、解碼生命為己任,專注于模式生物領域,打造了以基因修飾動物模型研發為核心,涵蓋多物種模型構建、飼養繁育、表型分析、藥物臨床前評價等多個技術平臺,致力于為全球高校、科研院所、制藥企業等客戶提供全方位、一體化的基因修飾動物模型產品解決方案。





