客戶案例 JHO (IF=23):脂肪細胞對三陰性乳腺癌鐵死亡具有保護作用
乳腺癌細胞通常被大量的脂肪細胞包圍,為癌前病變細胞提供一個獨特的微環境。脂肪細胞對乳腺癌脂質代謝有重塑作用,游離脂肪酸(FFA)和脂滴可使乳腺癌細胞更具侵襲性。鐵死亡是一種非細胞凋亡、細胞壞死、細胞自噬的新型的細胞程序性死亡方式,參與了包括三陰性乳腺癌(TNBC)在內的多種癌癥的發生、發展和治療靶點。有研究發現,多不飽和脂肪酸(PUFAs)可誘導脂質雙分子層過氧化,外源性單不飽和脂肪酸(MUFAs)可抑制鐵死亡。然而,目前乳腺脂肪細胞對TNBC鐵死亡的影響尚不清楚。
2022年6月,復旦大學附屬腫瘤醫院胡夕春教授、王碧蕓教授、陳光亮教授團隊在Journal of Hematology & Oncology(IF=23.168)期刊在線發表題為“Mammary adipocytes protect triple‑negative breast cancer cells from ferroptosis”的文章。本研究通過體內外實驗發現了脂肪細胞可以分泌特定的脂肪酸誘導乳腺癌細胞產生鐵死亡抵抗,且該過程依賴于脂肪酸合成酶ACSL3,證實了與腫瘤周圍脂肪細胞共培養的乳腺癌細胞顯示出對鐵死亡的抵抗。此外,研究團隊還通過動物模型驗證了脂肪細胞對三陰性乳腺癌的鐵死亡保護。(麥特繪譜為本研究提供脂質組學檢測分析)

研究人員首先建立乳腺脂肪細胞-乳腺癌細胞共培養體系,72h后發現共培養組的脂滴明顯多于常規培養組。研究人員選擇磺胺吡啶(SAS)作為鐵死亡誘導劑,通過BODIPY™581/591C11染色檢測脂質過氧化水平發現,TNBC細胞系BT-549和MDA-MB-231中,SAS誘導鐵死亡發生均會導致細胞內脂質-ROS升高。

圖1. 脂肪細胞-乳腺癌細胞共培養體系
通過流式細胞術檢測發現,與正常培養的細胞相比,共培養的細胞顯著抑制脂質過氧化,并在使用鐵死亡抑制劑ferrostatin-1的同時得到一定程度的逆轉。透射電子顯微鏡(TEM)也發現,與共培養細胞相比,SAS處理后的正常培養細胞線粒體過氧化現象明顯增加,此外,SAS處理后共培養細胞的抑制率顯著降低,克隆數顯著增加,ferrostatin-1也能部分恢復生長抑制。研究人員還引入了凋亡抑制劑Z-VAD-FMK和自噬抑制劑3-MA,發現與ferrostatin-1相比,它們不能恢復SAS處理的細胞活力。這些結果提示脂肪細胞對乳腺癌細胞鐵死亡有抑制作用。
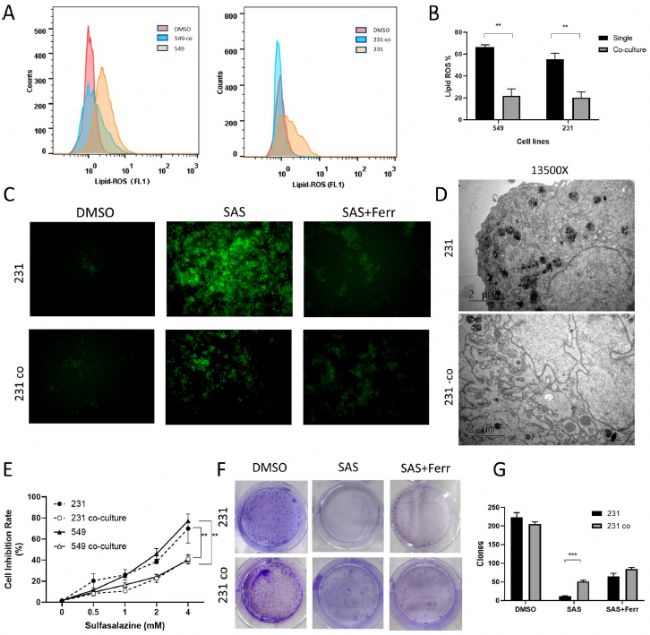
圖2. 乳腺脂肪細胞保護乳腺癌細胞免于鐵死亡
隨后,研究人員對共培養和正常培養的MDA-MB-231細胞系進行脂質組學分析,結果顯示共培養細胞中88種代謝物上調,12種代謝物下調。與正常培養的細胞相比,共培養細胞的磷脂生物合成途徑有很大的提高。這些發現進一步說明,脂肪細胞通過磷脂生物合成相關代謝物抑制鐵死亡,而含酸磷脂在鐵死亡中起著至關重要的作用。此外,共培養的細胞系中非酯化脂肪酸(NEFA)水平顯著高于正常培養的細胞系。
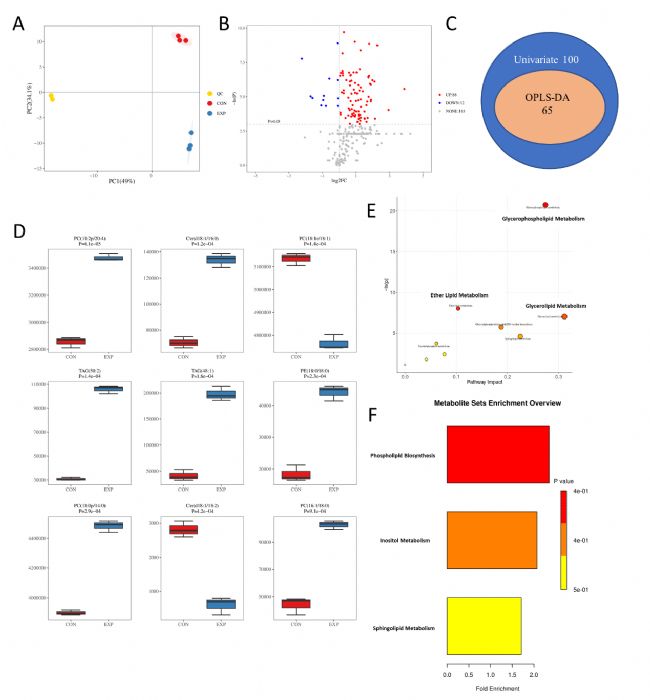
圖3. 脂質組學分析
引入外源性甘油、油酸(MUFA)和硬脂酸(PUFA)后,與對照組相比,外源性油酸組顯著抑制了脂質-ROS水平。細胞活力測試和克隆形成也顯示了類似的結果。既往研究表明,外源性MUFA可以通過纖維肉瘤細胞和黑色素瘤細胞酰基輔酶A合成酶長鏈家族成員3 (ACSL3)依賴的方式降低質膜脂對致命氧化的敏感性。因此,研究人員使用shRNA對ACSL3敲低的細胞系進行研究,發現sh-ACSL3的脂質-ROS水平在脂肪細胞共培養組和外源性MUFA組中對BT-549和MDA-MB-231細胞系鐵死亡的保護作用相反。
最后,在體內研究中,研究人員將MDA-MB-231細胞接種于裸鼠左腹股溝脂肪墊(FP)和右背部皮下(SC)。然后,小鼠接受SAS治療。結果顯示,整個給藥期間,處理組和對照組小鼠體重無顯著差異,耐受良好。與體外實驗結果一致,鐵死亡誘導劑SAS在SC組而非FP組中顯著降低了腫瘤生長,表明脂肪細胞對鐵死亡具有保護作用。
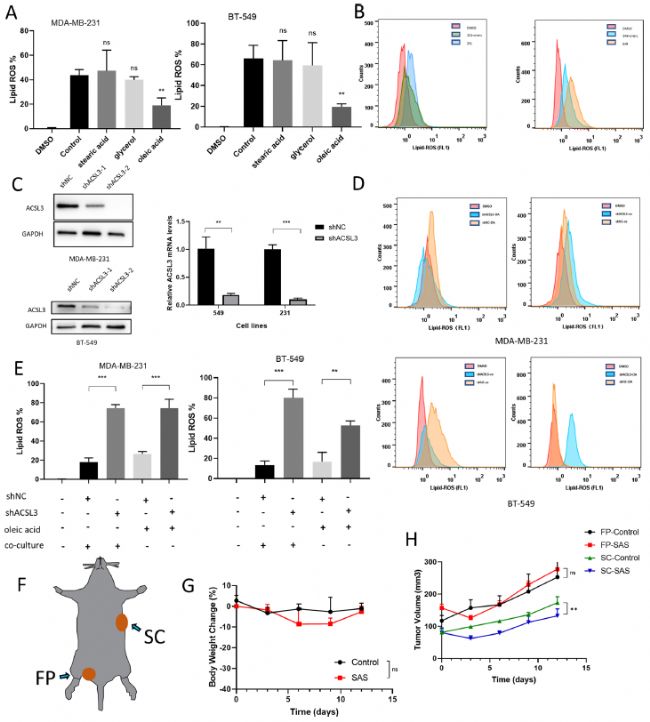
圖4. 脂肪細胞在ACSL3存在的情況下,通過油酸保護乳腺癌細胞免于鐵死亡
此外,研究人員通過油紅色染色發現FP腫瘤中脂質增加,通過TEM發現SC腫瘤中線粒體損傷增加,SC腫瘤中谷胱甘肽過氧化物酶4 (GPX4)和可溶性載體家族7成員11 (SLC7A11)水平降低,這進一步證明了上述發現。有趣的是,此前的研究發現,淋巴結可以通過產生MUFA來保護黑色素瘤細胞免于鐵死亡,從而增加腫瘤轉移,在一定程度上與本研究結果相一致。
綜上,本研究通過脂質組學、脂肪細胞-癌細胞共培養體系和體內細胞接種實驗,發現脂肪細胞在ACSL3存在的情況下,通過脂代謝物MUFA保護乳腺癌細胞免于鐵死亡。相信隨著未來越來越多的臨床試驗在癌癥患者中開展,這些發現或可為腫瘤治療提供新思路。
原文文獻
Mammary adipocytes protect triple-negative breast cancer cells from ferroptosis. Journal of Hematology & Oncology. 2022.
請掃碼二維碼閱讀原文

上述研究由麥特繪譜提供脂質組學檢測分析,近年來部分脂質組學客戶案例如下:
①
●香港大學:SCD1/FADS2 fatty acid desaturases equipoise lipid metabolic activity and redox-driven ferroptosis in ascites-derived ovarian cancer cells
● Theranostics 2022 IF=11.6
● 研究內容:SCD1/FADS2脂肪酸去飽和酶控制卵巢癌細胞腹膜轉移機制
②
●云南大學:mmBCFA C17iso ensures endoplasmic reticulum integrity for lipid droplet growth
● Journal of Cell Biology 2021 IF=10.539
● 研究內容:支鏈脂肪酸維護內質網穩態調控脂滴增長
③
● 云南大學:S100A11 Promotes Liver Steatosis via FOXO1-Mediated Autophagy and Lipogenesis
● Cellular and Molecular Gastroenterology and Hepatology 2020 IF=7.076
● 研究內容:S100A11通過FOXO1介導的自噬和脂肪生成促進肝臟脂肪變性
繪譜幫你測
麥特繪譜擁有成熟的代謝組學靶向和非靶向檢測平臺,包括全球獨有技術Q600、Q300、Q200和各類小分子代謝物獨立檢測方法,菌群16S測序和宏基因組、轉錄組學及多組學聯合分析等全套解決方案。獨家的檢測技術、全面的數據報告以及專業的售后探討,助力您的科研探索之路不斷創新和突破。歡迎聯系獲取詳細資料!
往期推薦
1. 客戶案例 | Microbiome:運動改善心功能不全,腸道菌群發揮重要作用
2. 客戶案例 | NC:西湖大學團隊發現飲茶或可降低慢性失眠帶來的心血管代謝病風險
3. 客戶案例 | Theranostics:香港大學研究團隊揭示SCD1/FADS2脂肪酸去飽和酶控制腹膜轉移新機制
4. 客戶案例 | PNAS:廈門大學林樹海團隊發現調控新冠肺炎抗體水平的血漿代謝物






